4.13: Reacciones de los alcanos - una breve descripción
- Page ID
- 76363
Objetivo de aprendizaje
- reconocer y distinguir entre las dos principales reacciones de alcanos: combustión y halogenación
Combustión
La combustión completa (dado suficiente oxígeno) de cualquier hidrocarburo produce dióxido de carbono y agua. Es muy importante que puedas escribir ecuaciones adecuadamente equilibradas para estas reacciones, ya que a menudo surgen como parte de los cálculos de termoquímica. Algunos son más fáciles que otros. Por ejemplo, con alcanos, ¡los que tienen un número par de átomos de carbono son marginalmente más duros que aquellos con un número impar!
Ejemplo: Combustión de propano
Por ejemplo, con propano (C 3 H 8), puedes equilibrar los carbonos e hidrógenos a medida que escribes la ecuación. Su primer borrador sería:
\[ C_3H_8 + O_2 \rightarrow 3CO_2 + 4H_2O\]
Contar los oxígenos conduce directamente a la versión final:
\[ C_3H_8 + 5O_2 \rightarrow 3CO_2 + 4H_2O\]
Ejemplo: Combustión de butano
Con butano (C 4 H 10), puedes volver a equilibrar los carbonos e hidrógenos a medida que escribes la ecuación.
\[ C_4H_{10} + O_2 \rightarrow 4CO_2 + 5H_2O\]
Contar los oxígenos conduce a un ligero problema, con 13 en el lado derecho. El truco sencillo es permitirte tener “seis y media” O 2 moléculas a la izquierda.
\[ C_4H_{10} + 6\dfrac{1}{2}\, O_2 \rightarrow 4CO_2 + 5H_2O\]
Si eso te ofende, duplica todo:
\[ 2C_4H_{10} + 13 O_2 \rightarrow 8CO_2 + 10 H_2O\]
Los hidrocarburos se vuelven más difíciles de encender a medida que las moléculas se hacen más grandes. Esto se debe a que las moléculas más grandes no se vaporizan tan fácilmente; la reacción es mucho mejor si el oxígeno y el hidrocarburo están bien mezclados como gases. Si el líquido no es muy volátil, solo aquellas moléculas en la superficie pueden reaccionar con el oxígeno. Las moléculas más grandes tienen mayores atracciones de Van der Waals, lo que dificulta que se separen de sus vecinos y se conviertan en un gas.
Siempre que la combustión esté completa, todos los hidrocarburos se quemarán con una llama azul. Sin embargo, la combustión tiende a ser menos completa a medida que aumenta el número de átomos de carbono en las moléculas. Eso significa que cuanto más grande sea el hidrocarburo, más probabilidades hay de obtener una llama amarilla y ahumada. La combustión incompleta (donde no hay suficiente oxígeno presente) puede conducir a la formación de carbono o monóxido de carbono. Como una forma sencilla de pensarlo, el hidrógeno en el hidrocarburo obtiene la primera oportunidad en el oxígeno, ¡y el carbono obtiene lo que queda! La presencia de partículas de carbono brillantes en una llama la vuelve amarilla, y el carbono negro a menudo es visible en el humo. El monóxido de carbono se produce como un gas venenoso incoloro.
Nota: Por qué el monóxido de carbono es venenoso
El oxígeno es transportado alrededor de la sangre por la hemoglobina, que desafortunadamente se une exactamente al mismo sitio en la hemoglobina que hace el oxígeno. La diferencia es que el monóxido de carbono se une irreversiblemente (o muy fuertemente), haciendo que esa molécula particular de hemoglobina sea inútil para transportar oxígeno. Si inhalas suficiente monóxido de carbono morirás por una especie de asfixia interna.
Halogenación de alcanos
La halogenación es la sustitución de uno o más átomos de hidrógeno en un compuesto orgánico por un halógeno (flúor, cloro, bromo o yodo). A diferencia de las complejas transformaciones de la combustión, la halogenación de un alcano parece ser una simple reacción de sustitución en la que se rompe un enlace C-H y se forma un nuevo enlace C-X. La cloración del metano, que se muestra a continuación, proporciona un ejemplo sencillo de esta reacción.
CH 4 + Cl 2 + energía → CH 3 Cl + HCl
Dado que solo se rompen dos enlaces covalentes (C-H y Cl-Cl) y se forman dos enlaces covalentes (C-Cl y H-Cl), esta reacción parece ser un caso ideal para la investigación y especulación mecanicistas. Sin embargo, una complicación es que todos los átomos de hidrógeno de un alcano pueden sufrir sustitución, dando como resultado una mezcla de productos, como se muestra en la siguiente ecuación desequilibrada. Las cantidades relativas de los diversos productos dependen de la proporción de los dos reactivos utilizados. En el caso del metano, un gran exceso del hidrocarburo favorece la formación de cloruro de metilo como producto principal; mientras que un exceso de cloro favorece la formación de cloroformo y tetracloruro de carbono.
CH 4 + Cl 2 + energía → CH 3 Cl + CH 2 Cl 2 + CHCl 3 + CCl 4 + HCl
En presencia de una llama, las reacciones son más bien parecidas a la del flúor, produciendo una mezcla de carbono y el haluro de hidrógeno. La violencia de la reacción disminuye considerablemente a medida que se pasa del flúor al cloro al bromo. Las reacciones interesantes ocurren en presencia de luz ultravioleta (la luz solar servirá). Se trata de reacciones fotoquímicas que ocurren a temperatura ambiente. Veremos las reacciones con cloro, aunque las reacciones con bromo son similares, pero evolucionan más lentamente.
Las reacciones de sustitución ocurren en las que los átomos de hidrógeno en el metano son reemplazados uno a la vez por átomos de cloro. Terminas con una mezcla de clorometano, diclorometano, triclorometano y tetraclorometano.
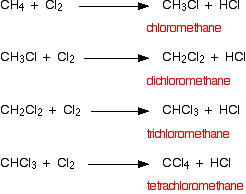
La mezcla original de un gas incoloro y uno verde produciría humos humeantes de cloruro de hidrógeno y una neblina de líquidos orgánicos. Todos los productos orgánicos son líquidos a temperatura ambiente con excepción del clorometano que es un gas.
Si estaba usando bromo, podría mezclar metano con vapor de bromo , o burbujear el metano a través del bromo líquido, en cualquier caso, expuesto a la luz UV. La mezcla original de gases sería, por supuesto, de color marrón rojizo en lugar de verde. Uno no elegiría usar estas reacciones como medio para preparar estos compuestos orgánicos en el laboratorio porque la mezcla de productos sería demasiado tediosa para separarse. Los mecanismos para las reacciones se explican en páginas separadas.
Alcanos más grandes y cloro
Volverías a obtener una mezcla de productos de sustitución, pero vale la pena solo mirar brevemente lo que sucede si solo uno de los átomos de hidrógeno se sustituye (monosustitución), ¡solo para demostrar que las cosas no siempre son tan sencillas como parecen! Por ejemplo, con propano, podrías obtener uno de dos isómeros:
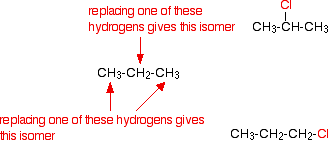
Si el azar fuera el único factor, se esperaría obtener tres veces más del isómero con el cloro al final. Hay 6 hidrógenos que podrían ser reemplazados en los átomos de carbono finales en comparación con solo 2 en el medio. De hecho, se obtiene aproximadamente la misma cantidad de cada uno de los dos isómeros. Si usas bromo en lugar de cloro, la gran mayoría del producto es donde el bromo está unido al átomo de carbono central.
Cicloalcanos
Las reacciones de los cicloalcanos son generalmente las mismas que las de los alcanos, con la excepción de las muy pequeñas, particularmente el ciclopropano. En presencia de luz UV, el ciclopropano sufrirá reacciones de sustitución con cloro o bromo al igual que un alcano no cíclico. Sin embargo, también tiene la capacidad de reaccionar en la oscuridad. En ausencia de luz UV, el ciclopropano puede sufrir reacciones de adición en las que se rompe el anillo. Por ejemplo, con bromo, el ciclopropano da 1,3-dibromopropano.
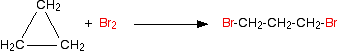
Esto todavía puede suceder en presencia de luz, pero también obtendrás reacciones de sustitución. El anillo está roto porque el ciclopropano sufre mucho de tensión del anillo. Los ángulos de unión en el anillo son de 60° en lugar del valor normal de aproximadamente 109.5° cuando el carbono forma cuatro enlaces simples. El solapamiento entre los orbitales atómicos en la formación de los enlaces carbono-carbono es menos bueno de lo que es normalmente, y hay considerable repulsión entre los pares de unión. El sistema se vuelve más estable si se rompe el anillo.
Ejercicio
1. Clasificar las siguientes reacciones como combustión o halogenación.
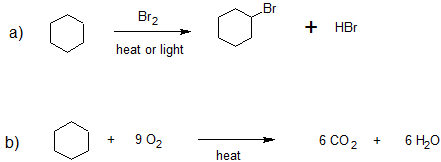
- Responder
-
1. a) halogentación
b) combustión
Colaboradores y Atribuciones
Jim Clark (Chemguide.co.uk)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

