5.2: Notación y símbolos del mecanismo de reacción
- Page ID
- 76332
Objetivo de aprendizaje
- utilizar con precisión y precisión la notación del mecanismo de reacción y símbolos, incluyendo flechas curvas para mostrar el flujo de electrones
La notación de flecha en los mecanismos
Dado que las reacciones químicas implican la ruptura y fabricación de enlaces, una consideración del movimiento de los electrones de capa de valencia de unión (y no unión) es esencial para esta comprensión. Ahora es una práctica común mostrar el movimiento de electrones con flechas curvas, y una secuencia de ecuaciones que representan las consecuencias de tales desplazamientos de electrones se denomina mecanismo. En general, se utilizan dos tipos de flechas curvas en los mecanismos de dibujo:
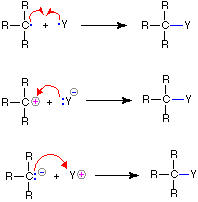
| Una cabeza completa en la flecha indica el movimiento o desplazamiento de un par de electrones: |  |
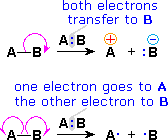 |
| Una cabeza parcial (anzuelo) en la flecha indica el desplazamiento de un solo electrón: |  |
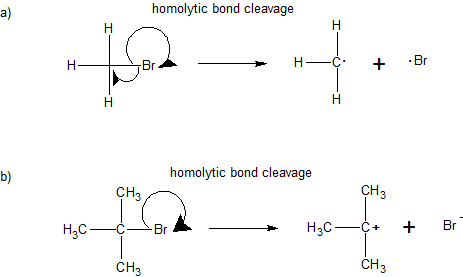
A continuación se ilustra el uso de estos símbolos en las reacciones de ruptura y de formación de enlaces. Si se rompe un enlace sencillo covalente para que quede un electrón del par compartido con cada fragmento, como en el primer ejemplo, esta ruptura de enlaces se denomina homólisis. Si el enlace se rompe con ambos electrones del par compartido permaneciendo con un fragmento, como en el segundo y tercer ejemplos, esto se denomina heterólisis.
| Rompiendo Vínes | Confección de enlaces | |
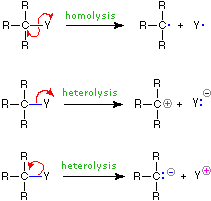 |
|
Otros símbolos de flecha
Los químicos también utilizan símbolos de flecha para otros fines, y es esencial usarlos correctamente.
|
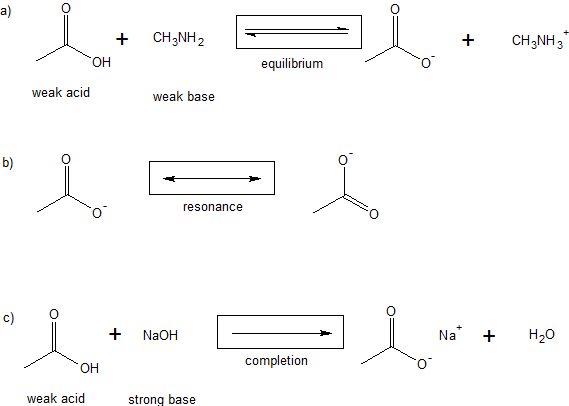
La flecha de reacción |
La Flecha de Equilibrio |
La flecha de resonancia |
 |
 |
|
Las siguientes ecuaciones ilustran el uso adecuado de estos símbolos:
Intermedios Reactivos
Los productos de ruptura de enlaces, mostrados anteriormente, no son estables en el sentido habitual, y no pueden aislarse para un estudio prolongado. Tales especies se denominan intermedios reactivos, y se cree que son intermedios transitorios en muchas reacciones. Las estructuras generales y los nombres de cuatro de estos intermedios se dan a continuación.

También se deben introducir aquí un par de términos ampliamente utilizados, relacionados con la notación ácido-base de Lewis.
- Electrofilo: Un átomo, ion o molécula deficiente en electrones que tiene afinidad por un par de electrones, y se unirá a una base o nucleófilo.
- Nucleófilo: Un átomo, ion o molécula que tiene un par de electrones que puede ser donado en unión a un electrófilo (o ácido de Lewis).
Usando estas definiciones, es claro que los carbocationes (llamados iones carbonio en la literatura más antigua) son electrófilos y los carbaniones son nucleófilos. Los carbenos solo tienen un sexteto de electrones de concha de valencia y, por lo tanto, son deficientes en electrones. En este sentido son electrófilos, pero el par de electrones no enlazantes también le da a los carbenos carácter nucleofílico. Como regla general, el carácter electrofílico domina la reactividad del carbeno. Los radicales de carbono tienen solo siete electrones de valencia, y pueden considerarse deficientes en electrones; sin embargo, en general no se unen a pares de electrones nucleofílicos, por lo que su química exhibe diferencias únicas con respecto a la de los electrófilos convencionales. Los intermedios radicales a menudo se llaman radicales libres.
La importancia de la terminología electrófilo/nucleófilo proviene del hecho de que muchas reacciones orgánicas implican en alguna etapa la unión de un nucleófilo a un electrófilo, proceso que generalmente conduce a un intermedio o producto estable. Las reacciones de este tipo a veces se denominan reacciones iónicas, ya que a menudo están involucrados reactivos o productos iónicos. Algunos ejemplos comunes de reacciones iónicas y sus mecanismos pueden examinarse a continuación.
Las formas idealmente asumidas por estos intermedios se vuelven importantes al considerar la estereoquímica de las reacciones en las que juegan un papel. Un compuesto tetravalente simple como el metano, CH 4, tiene una configuración tetraédrica. Los carbocationes tienen solo tres enlaces al carbono portador de carga, por lo que adopta una configuración trigonal plana. Los carbaniones tienen forma piramidal (tetraédricos si el par de electrones es visto como un sustituyente), pero estas especies se invirtieron rápidamente a temperatura ambiente, pasando por una forma plana de mayor energía en la que el par de electrones ocupa un orbital p. Los radicales son de configuración intermedia, siendo muy pequeña la diferencia de energía entre las formas piramidales y planas. Dado que tres puntos determinan un plano, la forma de los carbenos debe ser plana; sin embargo, la distribución de electrones de valencia varía.
Reacciones Iónicas
Los principios y términos introducidos en las secciones anteriores ahora pueden resumirse e ilustrarse con los siguientes tres ejemplos. Reacciones como estas se denominan reacciones iónicas o polares, porque a menudo involucran especies cargadas y la unión entre electrófilos y nucleófilos. Las reacciones iónicas normalmente tienen lugar en soluciones líquidas, donde las moléculas de disolvente ayudan a la formación de intermedios cargados.
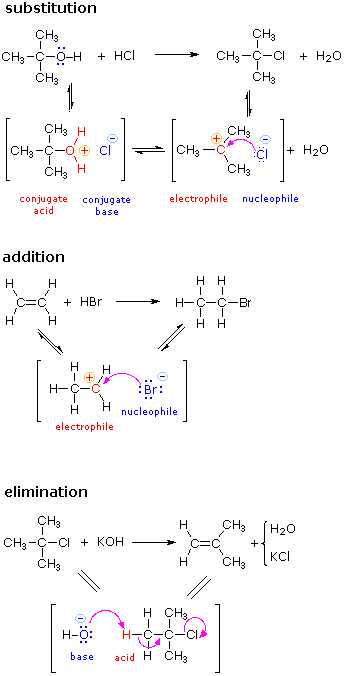 |
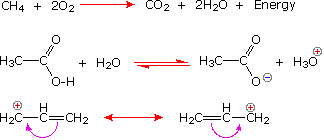
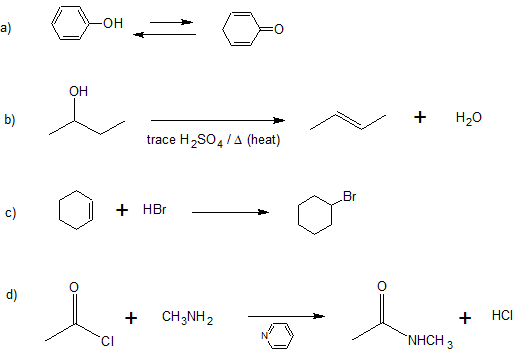
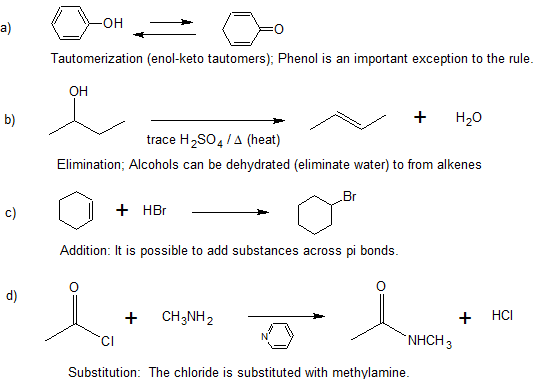
La reacción de sustitución mostrada a la izquierda puede verse como ocurriendo en tres etapas. El primero es un equilibrio ácido-base, en el que HCl protonaba el átomo de oxígeno del alcohol. El ácido conjugado resultante pierde agua en una segunda etapa para dar un intermedio de carbocatión. Finalmente, este electrófilo se combina con el nucleófilo anión cloruro para dar el producto final. |
|
La reacción de adición que se muestra a la izquierda se puede ver como que tiene lugar en dos etapas. El primer paso puede considerarse nuevamente un equilibrio ácido-base, con los electrones pi-del doble enlace carbono-carbono funcionando como base. El ácido conjugado resultante es un carbocatión, y este electrófilo se combina con el anión bromuro nucleófilo. |
|
|
La reacción de eliminación que se muestra a la izquierda tiene lugar en un solo paso. Las operaciones de rotura y confección de uniones que se realizan en este paso son descritas por las flechas curvas. La etapa inicial también puede verse como una interacción ácido-base, con iones hidróxido que sirve como base y un componente de átomo de hidrógeno del cloruro de alquilo como un ácido. |
|
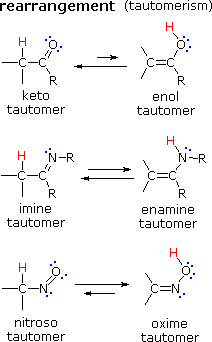 |
Hay muchos tipos de reordenamientos moleculares llamados isomerizaciones. Los ejemplos que se muestran a la izquierda son de una clase importante llamada tautomerización o, más específicamente, tautomerización de ceto-enol. Los tautomeros son isómeros constitucionales rápidamente interconvertidos, generalmente se distinguen por una ubicación de enlace diferente para un átomo de hidrógeno lábil (aquí coloreado de rojo) y un doble enlace ubicado de manera diferente. El equilibrio entre los tautomeros no solo es rápido en condiciones normales, sino que a menudo favorece fuertemente a uno de los isomeros (la acetona, por ejemplo, es 99.999% ceto tautomero). Incluso en esos equilibrios unilaterales, la evidencia de la presencia del tautomero menor proviene del comportamiento químico del compuesto. Los equilibrios tautoméricos son catalizados por trazas de ácidos o bases que generalmente están presentes en la mayoría de las muestras químicas. |
Ejercicio
1. Agregar flechas curvas para explicar la reactividad indicada y clasificar la reacción como “escisión homolítica” o “escisión heterolítica”.
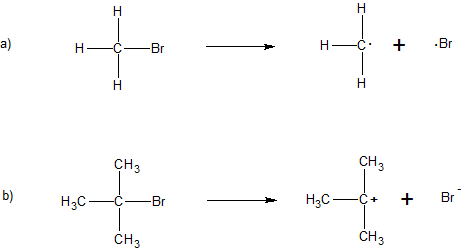
2. Agrega la flecha correcta a cada expresión a continuación utilizando tus conocimientos de química.
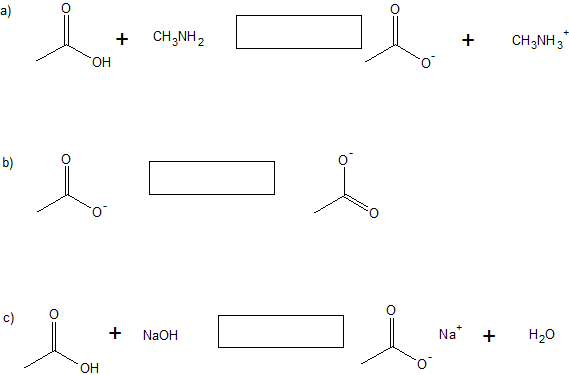
3. Clasificar las siguientes reacciones como sustitución, adición, eliminación o tautomerización (un ejemplo de isomerización).
- Contestar
-
1.
2.
3.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry