5.4: Describir una reacción - Equilibrio y cambios de energía libre
- Page ID
- 76311
Objetivo de aprendizaje
- realizar cálculos usando la ecuación\[ΔGº = –RT \ln K = –2.303 RT \log_{10} K \label{eq2}\] y explicar la relación entre equilibrio y energía libre
Constante de Equilibrio
Para la hipotética reacción química:
\[aA + bB \rightleftharpoons cC + dD\]
la constante de equilibrio se define como:
\[K_C = \dfrac{[C]^c[D]^d}{[A]^a[B]^b}\]
donde la notación [A] significa la concentración molar de especies A. Obsérvese que la expresión para la constante de equilibrio incluye solo solutos y gases; los sólidos y líquidos puros no aparecen en la expresión. Por ejemplo, la expresión de equilibrio para la reacción
\[\ce{CaH_2 (s) + 2H_2O (g) \rightleftharpoons Ca(OH)_2 (s) + 2H_2 (g)} \]
es la siguiente:
\[K_C = \dfrac{[H_2]^2}{[H_2O]^2}\]
Observar que las especies en fase gaseosa\(\ce{H2O}\) y\(\ce{H2}\) aparecen en la expresión pero los sólidos\(\ce{CaH2}\) y\(\ce{Ca(OH)2}\) no aparecen.
La constante de equilibrio se determina más fácilmente permitiendo que una reacción alcance el equilibrio, midiendo las concentraciones de los diversos reactivos y productos en fase de solución o fase gaseosa, y sustituyendo estos valores en la Ley de Acción de Masas.
Energía Libre
La interacción entre los cambios de entalpía y entropía en las reacciones químicas se observa mejor al estudiar su influencia en las constantes de equilibrio de las reacciones reversibles. Para ello se define una nueva función termodinámica llamada Energía Libre (o Energía Libre de Gibbs), símbolo\(ΔG\), como se muestra en la primera ecuación a continuación. Dos cosas deberían ser evidentes a partir de esta ecuación. Primero, en los casos donde el cambio de entropía es pequeño,\(ΔG ≅ ΔH\). Segundo, la importancia de\(ΔS\) en la determinación de\(ΔG\) incrementos con el aumento de la temperatura.
\[ΔGº = ΔHº – TΔSº\]
donde la temperatura se mide en temperatura absoluta (K).
La función de energía libre proporciona una mejor comprensión de las fuerzas motrices termodinámicas que influyen en las reacciones. Un negativo\(ΔGº\) es característico de una reacción exergónica, una que es termodinámicamente favorable y a menudo espontánea, como lo es el derretimiento del hielo a 1 ºC. De igual manera un positivo\(ΔGº\) es característico de una reacción endergónica, una que requiere un aporte de energía del entorno.
Para un ejemplo de la relación de la energía libre con la entalpía considere la descomposición del ciclobutano en eteno, que se muestra en la siguiente ecuación. El estado estándar para todos los compuestos es gaseoso.
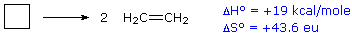
Esta reacción es endotérmica, pero el incremento en el número de moléculas de uno (reactivos) a dos (productos) da como resultado un gran δSº positivo.
A 25 ºC (298 K):
ΔGº = 19 kcal/mol — 298 (43.6) cal/mol = 19 — 13 kcal/mol = +6 kcal/mol.
Así, el cambio de entropía se opone al cambio de entalpía, pero no es suficiente para cambiar el signo del cambio de energía libre resultante, que es endergónico. De hecho, el ciclobutano es perfectamente estable cuando se mantiene a temperatura ambiente.
Debido a que el aporte de entropía aumenta con la temperatura, esta transformación energéticamente desfavorable se puede hacer favorable elevando la temperatura. A 200 ºC (473 K),
\[\begin{align} ΔGº &= 19\, kcal/mol – 473(43.6)\, cal/mole \\[4pt] &= 19 – 20.6\, kcal/mole \\[4pt] &= –1.6 kcal/mole.\end{align}\]
Esta es ahora una reacción exergónica, y se sabe que el craqueo térmico de ciclobutano a eteno ocurre a temperaturas más altas.
\[ΔGº = –RT \ln K = –2.303 RT \log_{10} K \label{eq2}\]
donde R = 1.987 cal/ K mol T = temperatura en K y K = constante de equilibrio
Nota
La ecuación\ ref {eq2} es importante porque demuestra la relación fundamental de\(ΔGº\) con la constante de equilibrio,\(K\). Debido a la relación logarítmica negativa entre estas variables, un ΔGº negativo genera un K>1, mientras que un ΔGº positivo genera un K<1. Cuando δGº = 0, K = 1. Además, pequeños cambios en ΔGº producen grandes cambios en K. Un cambio de 1.4 kcal/mol en ΔGº cambia K en aproximadamente un factor de 10. Esta interrelación se puede explorar con la calculadora de la derecha. Ingresar energías libres fuera del rango -8 a 8 kcal/mol o constantes de equilibrio fuera del rango 10 -6 a 900,000 activará una alerta, indicando el gran desequilibrio que implican dichos números.
Aplicaciones a Reacciones Orgánicas
La siguiente ecuación también puede ser útil sin realizar ningún cálculo.
\[ΔGº = –RT \ln K = –2.303 RT \log_{10} K \label{eq2}\]
Conceptualmente, esta ecuación nos ayuda a comparar la energía de los mecanismos de reacción para predecir los principales productos. Por ejemplo, si ΔG° < 0, then K > 1, y los productos son favorecidos sobre los reactivos. Si ΔG° > 0, entonces K < 1, y los reactivos son favorecidos sobre los productos. Si ΔG° = 0, entonces K = 1, y el sistema está en equilibrio. Reconociendo la energía subyacente del equilibrio, la estabilidad de los reactivos y productos cargados puede usarse para predecir el equilibrio de la reacción. Las condiciones de reacción también se pueden ajustar o controlar para desplazar el equilibrio en la dirección deseada mediante una gama de métodos experimentales. Una comprensión teórica de la energía libre de reacción y el equilibrio nos ayuda a predecir y diseñar las condiciones óptimas de reacción para un producto deseado.
Ejercicios
- A 155°C, la constante de equilibrio, K eq, para la reacción
\[\ce{\sf{CH3CO2H + CH3CH2OH <=> CH3CO2CH2CH3 + H2O}}\]
tiene un valor de 4.0. Calcular ΔG° para esta reacción a 155°C.
- El acetileno (C 2 H 2) se puede convertir en benceno (C 6 H 6) de acuerdo con la ecuación:
\[\ce{\sf{3H-C#C-H (g) <=> C6H6 (l)}}\]
A 25°C, ΔG° para esta reacción es −503 kJ y ΔH° es −631 kJ. Determine ΔS° e indique si el tamaño de ΔS° concuerda con lo que habría predicho simplemente mirando la ecuación química.
- Contestar
-
Δ G° = − R T ln K eq = − (8.314 J ⋅ K − 1 ⋅ mol − 1) (428 K) ln (4.0) = − (8.314 J ⋅ K − 1 ⋅ mol − 1) (428 K) (1.386) = − 4.9 × 10 3 J ⋅ mol − 1 = − 4.9 KJ ⋅ mol − 1 Δ G° = Δ H° − T Δ° S Δ S =° (Δ H° − Δ G°) T = − 631 kJ − (− 503 kJ) 298 K = − 128 kJ 298 K = − 0.430 KJ ⋅ mol − 1 = − 430 J ⋅ mol − 1
El cambio de entropía es negativo, como cabría esperar al mirar la ecuación química, ya que tres moles de reactivos producen un mol de producto; es decir, el sistema se vuelve mucho más “ordenado” a medida que pasa de reactivos a productos.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Jim Clark (Chemguide.co.uk)

