5.8: Intermedios Reactivos - Radicales
- Page ID
- 76338
Objetivo de aprendizaje
- describir la estructura y las estabilidades relativas de los radicales libres
Radicales
En química, un radical (más precisamente, un radical libre) es un átomo, molécula o ion que tiene electrones de valencia desapareados o una capa de electrones abierta, y por lo tanto puede verse como que tiene uno o más enlaces covalentes “colgando”.
Con algunas excepciones, estos enlaces “colgados” hacen que los radicales libres sean altamente reactivos químicamente hacia otras sustancias, o incluso hacia ellos mismos: sus moléculas a menudo se dimerizan o polimerizan espontáneamente si entran en contacto entre sí. La mayoría de los radicales son razonablemente estables solo a concentraciones muy bajas en medios inertes o en vacío.
Un ejemplo notable de un radical libre es el radical hidroxilo (HO•), una molécula que está a un átomo de hidrógeno por debajo de una molécula de agua y por lo tanto tiene un enlace “colgando” del oxígeno. Otros dos ejemplos son la molécula de carbeno (: CH2), que tiene dos enlaces colgando; y el anión superóxido (•O−2), la molécula de oxígeno O2 con un electrón extra, que tiene un enlace colgando. En contraste, el anión hidroxilo (HO−), el anión óxido (O2−) y el catión de carbono (CH+3) no son radicales, ya que los enlaces que pueden parecer colgando se resuelven de hecho por la adición o eliminación de electrones.
Los radicales libres se pueden crear de varias maneras, incluyendo síntesis con reactivos muy diluidos o enrareados, reacciones a temperaturas muy bajas o ruptura de moléculas más grandes. Este último puede verse afectado por cualquier proceso que ponga suficiente energía en la molécula parental, como radiación ionizante, calor, descargas eléctricas, electrólisis y reacciones químicas. De hecho, los radicales son etapas intermedias en muchas reacciones químicas.
Los radicales libres juegan un papel importante en la combustión, la química atmosférica, la polimerización, la química del plasma, la bioquímica y muchos otros procesos químicos. En los organismos vivos, los radicales libres superóxido y óxido nítrico y sus productos de reacción regulan muchos procesos, como el control del tono vascular y por lo tanto la presión arterial. También desempeñan un papel clave en el metabolismo intermediario de diversos compuestos biológicos. Tales radicales pueden incluso ser mensajeros en un proceso denominado señalización redox. Un radical puede quedar atrapado dentro de una jaula de disolvente o estar unido de otra manera.
Hasta finales del siglo XX la palabra “radical” se usaba en química para indicar cualquier grupo conectado de átomos, como un grupo metilo o un carboxilo, ya fuera parte de una molécula más grande o de una molécula por sí sola. Entonces se necesitaba el calificador “libre” para especificar el caso no enlazado. Después de revisiones recientes de nomenclatura, una parte de una molécula más grande ahora se llama grupo funcional o sustituyente, y “radical” ahora implica “libre”. Sin embargo, la nomenclatura antigua aún puede aparecer en la literatura.
Formación
La formación de radicales puede implicar la ruptura de enlaces covalentes homolíticamente, un proceso que requiere cantidades significativas de energía. Por ejemplo, dividir H 2 en 2H · tiene un Δ H° de +435 kJ/mol, y Cl 2 en 2Cl · tiene un Δ H° de +243 kJ/mol. Esto se conoce como la energía de disociación del enlace homolítico, y suele abreviarse como el símbolo Δ H°. La energía de enlace entre dos átomos unidos covalentemente se ve afectada por la estructura de la molécula como un todo, no solo por la identidad de los dos átomos. Asimismo, los radicales que requieren más energía para formarse son menos estables que aquellos que requieren menos energía. La escisión del enlace homolítico ocurre con mayor frecuencia entre dos átomos de electronegatividad similar. En química orgánica este suele ser el enlace O-O en especies de peróxido o enlaces O-N. En ocasiones la formación radical está prohibida por el giro, presentando una barrera adicional. Sin embargo, la propagación es una reacción muy exotérmica. Asimismo, aunque existen iones radicales, la mayoría de las especies son eléctricamente neutras. Los radicales también pueden formarse por oxidación de electrones simples o reducción de un átomo o molécula. Un ejemplo es la producción de superóxido por la cadena de transporte de electrones. Los primeros estudios de química organometálica, especialmente especies de tetra-alquil plomo por F. A. Paneth y K. Hahnfeld en la década de 1930 apoyaron la fisión heterolítica de enlaces y un mecanismo basado en radicales.
Representación en reacciones químicas
En las ecuaciones químicas, los radicales libres se denotan frecuentemente por un punto colocado inmediatamente a la derecha del símbolo atómico o fórmula molecular de la siguiente manera:
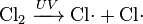
- El gas cloro puede ser descompuesto por la luz ultravioleta para formar radicales de cloro atómicos.
Los mecanismos de reacción radical utilizan flechas de una sola cabeza para representar el movimiento de electrones simples:

La escisión homolítica del enlace de ruptura se dibuja con una flecha “anzuelo” para distinguir del movimiento habitual de dos electrones representados por una flecha rizada estándar. Cabe señalar que el segundo electrón del enlace de ruptura también se mueve para emparejarse con el electrón radical atacante; esto no se indica explícitamente en este caso.
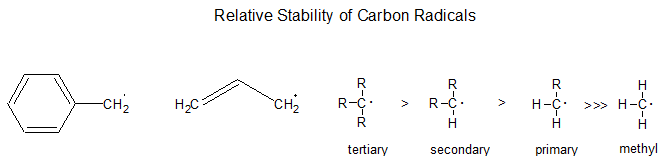
Estabilidad relativa
Los intermedios de alquilo radical se estabilizan mediante procesos físicos similares a los carbocationes: como regla general, cuanto más sustituido está el centro radical, más estable es. Esto dirige sus reacciones. Así, se favorece la formación de un radical terciario (R 3 C·) sobre el secundario (R 2 HC·), el cual se favorece sobre el primario (RH 2 C·). Asimismo, los radicales próximos a grupos funcionales como carbonilo, nitrilo y éter son más estables que los radicales alquilo terciarios.
Ejercicio
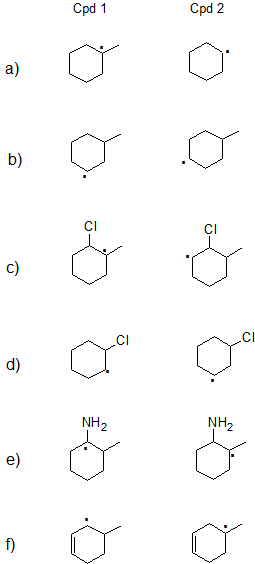
1. Afirma qué radical de carbono (radical libre) en cada par a continuación es más estable o si se espera que tengan estabilidad comparable. Explica tu razonamiento.
- Contestar
- 1.
a) Cpd 1: Los radicales terciarios son más estables que los radicales secundarios.
b) Los Cpds 1 y 2 son secundarios, por lo que tienen una estabilidad comparable.
c) Cpd 1: Los radicales terciarios son más estables que los secundarios con efectos similares del átomo de Cl.
d) Cpd 2: Ambos compuestos son secundarios, pero la carga positiva está más lejos del cloro que retira electrones en el Cpd 2.
e) Cpd 1: El par solitario sobre nitrógeno puede donar electrones por resonancia.
f) Cpd 1: Los radicales alílicos secundarios son más estables que los radicales terciarios. (Los radicales alílicos primarios son comparables en estabilidad a los radicales terciarios).

