5.9: Intermedios Reactivos- Carbaniones y Ácidos de Carbono
- Page ID
- 76310
Carbaniones
Un carbanión es un anión en el que el carbono tiene un par de electrones no compartidos y lleva una carga negativa generalmente con tres sustituyentes para un total de ocho electrones de valencia. [1] El carbanión existe en una geometría piramidal trigonal. Formalmente, un carbanión es la base conjugada de un ácido de carbono.
\[\ce{R_3C-H + B^- \rightarrow R_3C^- + H-B}\]
donde B representa la base. Un carbanión es uno de varios intermedios reactivos en química orgánica.
Un carbanión es un nucleófilo, cuya estabilidad y reactividad se determina por varios factores:
- El efecto inductivo. Los átomos electronegativos adyacentes a la carga estabilizarán la carga;
- Hibridación del átomo portador de carga. Cuanto mayor es el carácter s del átomo portador de carga, más estable es el anión;
- El grado de conjugación del anión. Los efectos de resonancia pueden estabilizar el anión. Esto es especialmente cierto cuando el anión se estabiliza como resultado de la aromaticidad.
Un carbanión es un intermedio reactivo y se encuentra en la química orgánica, por ejemplo, en la reacción de eliminación de E1cb y en la química organometálica, por ejemplo, en una reacción de Grignard o en la química de alquil-litio. Sin embargo, existen carbaniones estables. En 1984 Olmstead presentó la sal de éter corona de litio del carbanión trifenilmetilo de trifenilmetano, n-butillitio y 12-corona-4 a bajas temperaturas: [2]
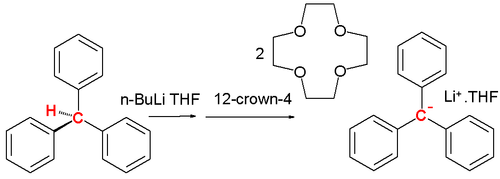
La adición de n-butillitio a trifenilmetano en THF a bajas temperaturas seguido de 12-corona-4 da como resultado una solución roja y el complejo salino precipita a −20 °C, las longitudes del enlace central C-C son 145pm con el anillo de fenilo propulsado en un ángulo promedio de 31.2°. Esta forma de hélice es menos pronunciada con un contraión de tetrametilamonio. [3] Una herramienta para la detección de carbaniones en solución es la RMN de protones. [4] Un espectro de ciclopentadieno en DMSO muestra cuatro protones vinílicos a 6.5 ppm y dos protones puente metileno a 3 ppm, mientras que el anión ciclopentadienilo tiene un resonancia única a 5.50 ppm.
Ácidos de carbono
Cualquier molécula que contenga un C-H puede perder un protón que forma el carbanión. Por lo tanto, cualquier hidrocarburo que contenga enlaces C-H puede considerarse un ácido con un valor de pKa correspondiente. El metano ciertamente no es un ácido en su significado clásico, pero su pKa estimado es 56. Compárelo con ácido acético con pKa 4.76. Los mismos factores que determinan la estabilidad del carbanión también determinan el orden en pKa en los ácidos de carbono. Estos valores se determinan para los compuestos ya sea en agua para compararlos con ácidos ordinarios, indimetilsulfóxido en el que la mayoría de los ácidos carbonados y sus aniones son solubles o en fase gaseosa. Con DMSO la ventana de acidez para solutos se limita a su propio pKa de 35.5.
| nombre | fórmula | fórmula estructural | pKa |
|---|---|---|---|
| Metano | CH 4 |  |
~ 56 |
| Ethane | C 2 H 6 |  |
~ 50 |
| Anisol | C 7 H 8 O |  |
~ 49 |
| Ciclopentano | C 5 H 10 |  |
~ 45 |
| Propeno | C 3 H 6 |  |
~ 44 |
| Benceno | C 6 H 6 |  |
~ 43 |
| Tolueno | C 6 H 5 CH 3 |  |
~ 43 |
| Dimetil sulfóxido | (CH 3) 2 SO |  |
35.5 |
| Difenilmetano | C 13 H 12 |  |
32.3 |
| Anilina | C 6 H 5 NH 2 |  |
30.6 |
| Trifenilmetano | C 19 H 16 |  |
30.6 |
| Xanteno | C 13 H 10 O |  |
30 |
| Etanol | C 2 H 5 OH |  |
29.8 |
| Fenilacetileno | C 8 H 6 |  |
28.8 |
| Tioxanteno | C 13 H 10 S |  |
28.6 |
| Acetona | C 3 H 6 O |  |
26.5 |
| Acetileno | C 2 H 2 |  |
25 |
| Benzoxazol | C 7 H 5 NO |  |
24.4 |
| Fluoreno | C 13 H 10 |  |
22.6 |
| Indene | C 9 H 8 |  |
20.1 |
| Ciclopentadieno | C 5 H 6 |  |
18 |
| Malononitrilo | C 3 H 2 N 2 |  |
11.2 |
| Cianuro de hidrógeno | HCN |  |
9.2 |
| Acetilacetona | C 5 H 8 O 2 |  |
8.95 |
| Dimedona | C 8 H 12 O 2 |  |
5.23 |
| Ácido de Meldrum | C 6 H 8 O 4 |  |
4.97 |
| Ácido acético | CH 3 COOH |  |
4.76 |
| Ácido barbitúrico | C 4 H 2 O 3 (NH) 2 |  |
4.01 |
| Trinitrometano | HC (NO 2) 3 |  |
0.17 |
| Ácido fulmínico | HCNO |  |
-1.07 |
| Superácido de carborano | HCHB 11 Cl 11 |  |
-9 |
Obsérvese que los aniones formados por la ionización de ácido acético, etanol o anilina no son carbaniones.
Partiendo del metano en la Tabla 1, la acidez aumenta:
- cuando el anión es aromático, ya sea porque el electrón agregado hace que el anión se vuelva aromático (como en indeno y ciclopentadieno), o porque la carga negativa sobre el carbono puede deslocalizarse sobre varios anillos ya aromáticos (como en el trifenilmetano o el superácido de carborano).
- cuando el carbanión está rodeado por grupos fuertemente electronegativos, a través de la neutralización parcial de la carga negativa (como en el malononitrilo).
- cuando el carbanión está inmediatamente al lado de un grupo carbonilo. Los protones α de los grupos carbonilo son ácidos porque la carga negativa en el enolato puede distribuirse parcialmente en el átomo de oxígeno. El ácido de Meldrum y el ácido barbitúrico, históricamente llamados ácidos, son de hecho una lactona y una lactama respectivamente, pero sus protones de carbono ácidos los hacen ácidos. La acidez de los compuestos carbonílicos es una fuerza impulsora importante en muchas reacciones orgánicas como la reacción aldólica.
Carbaniones quirales
Con la geometría molecular para un carbanión descrito como pirámide trigonal la cuestión es si los carbaniones pueden o no mostrar quiralidad, ya que si la barrera de activación para la inversión de esta geometría es demasiado baja cualquier intento de introducir quiralidad terminará con la inracemización, similar a la inversión de nitrógeno. Sin embargo, existe evidencia sólida de que los carbaniones pueden ser quirales, por ejemplo, en investigaciones realizadas con ciertos compuestos de organolitio.
La primera evidencia de la existencia de compuestos quirales de organolitio se obtuvo en 1950. La reacción de 2-yodooctano quiral con sec-butillitio en éter de petróleo a -70 °C seguida de reacción con hielo seco produjo principalmente ácido 2-metilbutírico racémico pero también una cantidad de ácido 2-metiloctanoico ópticamente activo que solo podría haberse formado a partir de 2-metilheptil-litio ópticamente activo con el átomo de carbono ligado al litio el carbanión: [6]
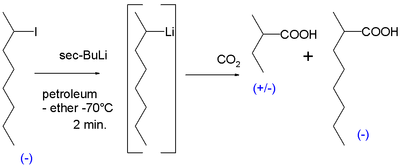
Al calentar la reacción a 0 °C se pierde la actividad óptica. Más pruebas siguieron en la década de 1960. Una reacción del isómero cis del bromuro de 2-metilciclopropilo con sec-butil-litio nuevamente seguida de carboxilación con hielo seco produjo ácido cis-2-metilciclopropilcarboxílico. La formación del isómero trans habría indicado que el carbanión intermedio era inestable. [7]
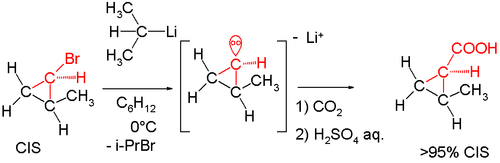
De la misma manera, la reacción de (+) - (S) -l-bromo-l-metil-2,2-difenilciclopropano con n-butil-litio seguido de inactivación con metanol dio como resultado un producto con retención de configuración: [8]
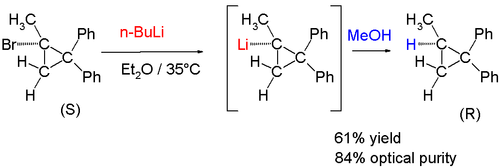
De fecha reciente son compuestos de metillitio quirales: [9]
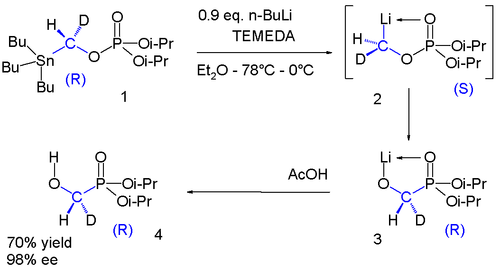
El fosfato 1 contiene un grupo quiral con un sustituyente hidrógeno y deuterio. El grupo estannilo se reemplaza por litio al intermedio 2 el cual se somete a un reordenamiento fosfato-fosforano a fosforano 3 que al reaccionar con ácido acético da el alcohol 4. Una vez más en el rango de −78 °C a 0 °C la quiralidad se conserva en esta secuencia de reacción. [10]
Historia
Una estructura carbaniónica apareció por primera vez en el mecanismo de reacción para la condensación de benzoína como lo propusieron correctamente Clarke y Lapworth en 1907. [11] En 1904 Schlenk preparó Ph3C-NMe4+ en una búsqueda de nitrógeno pentavalente (de cloruro de tetrametilamonio y Ph3CNa) [12] y en 1914 demostró cómo los radicales triarilmetilo podrían reducirse a carbcebollas por los metales alcalinos. [13] La frase carbanión fue introducida por Wallis y Adams en 1933 como la contraparte cargada negativamente del ion carbonio. [14] [15]
Enlaces externos
- Gran base de datos de valores de pKa de Bordwell en www.chem.wisc.edu Enlace
- Gran base de datos de valores de pKa de Bordwell en daecr1.harvard.edu Enlace
Referencias
- Química Orgánica - Robert Thornton Morrison, Robert Neilson Boyd
- El aislamiento y las estructuras de rayos X de las sales de éter corona de litio de los carbaniones de fenilo libres [CHpH2] - y [CPh3] - Marilyn M. Olmstead, Philip P. Power; J. Am. Chem. Soc.; 1985; 107 (7); 2174-2175. doi: 10.1021/ja00293a059
- Harder, Sjoerd (2002). “Los primeros carbaniones “libres” de Schlenk”. Química - A European Journal 8 (14): 3229—3232. doi:10.1002/1521-3765 (20020715) 8:14 <3229::AID-CHEM3229>3.0.CO; 2-3.
- Un Método Simple y Conveniente para la Generación y Observación por RMN de Carbaniones Estables. Hamid S. Kasmai Revista de Educación Química • Vol. 76 No. 6 de junio de 1999
- Acidedades de equilibrio en solución de dimetilsulfóxido Frederick G. Bordwell Acc. Chem. Res.; 1988; 21 (12) pp 456 - 463; doi:10.1021/ar00156a004
- FORMACIÓN DE 1-METHYLHEPTILLITIO OPTICAMENTE ACTIVO Robert L. Letsinger J. Chem. Soc.; 1950; 72 (10) pp 4842 - 4842; doi:10.1021/ja01166a538
- La estabilidad configuracional del cis- y trans-2-metilciclopropillitio y algunas observaciones sobre la estereoquímica de sus reacciones con bromo y dióxido de carbono Douglas E. Applequist y Alan H. Peterson J. Am. Chem. Soc.; 1961; 83 (4) pp 862 - 865; doi: 10.1021/ja01465a030
- Ciclopropanos. XV. La estabilidad óptica del 1-metil-2,2-difenilciclopropillitio H. M. Walborsky, F. J. Impastato, y A. E. Young J. Am. Chem. Soc.; 1964; 86 (16) pp 3283 - 3288; doi: 10.1021/ja01070a017
- Preparación de -Oxy- [2H1] metillitios quirales de 99% ee y determinación de su estabilidad configuracional Dagmar Kapeller, Roland Barth, Kurt Mereiter y Friedrich Hammerschmidt J. Am. Chem. Soc.; 2007; 129 (4) pp 914 - 923; (Artículo) doi: 10.1021/ja066183s
- Enantioselectividad determinada por espectroscopía de RMN tras derivatización con ácido de Mosher
- Clarke, R. W. L.; Lapworth, A. (1907). “LXV.? Una extensión de la síntesis de benjuí”. Revista de la Sociedad Química, Transacciones 91: 694. doi: 10.1039/CT9079100694.
- Schlenk, W.; Weickel, T.; Herzenstein, A. (1910). “Ueber Trifenilmetilo und Analoga des Trifenilmetilos en der Bifenilreihe. [Zweite Mittheilung über “Triarylmethyle”.]”. Justus Liebig's Annalen der Chemie 372: 1. doi: 10.1002/jlac.19103720102.
- Schlenk, W.; Marcus, E. (1914). “Über Metalladditinen an freie organische Radikale. (Über Triarilmetilo. XII.)”. Berichte der deutschen chemischen Gesellschaft 47 (2): 1664. doi: 10.1002/cber.19140470256.
- Wallis, E. S.; Adams, F. H. (1933). “La Configuración Espacial de las Valencias en Compuestos de Carbono Tricovalente1". Revista de la Sociedad Americana de Química 55 (9): 3838. doi: 10.1021/ja01336a068.
- Tidwell, T. T. (1997). “El primer siglo de la química física orgánica: Un prólogo”. Química Pura y Aplicada 69 (2): 211—214. doi: 10.1351/pac199769020211. edi

