5.10: La halogenación por radicales libres de alcanos
- Page ID
- 76293
Los alcanos (el más básico de todos los compuestos orgánicos) experimentan muy pocas reacciones. Una de estas reacciones es la halogenación, o la sustitución de un solo hidrógeno en el alcano por un solo halógeno para formar un haloalcano. Esta reacción es muy importante en la química orgánica porque abre una puerta de entrada a futuras reacciones químicas.
Introducción
Si bien las reacciones posibles con alcanos son pocas, hay muchas reacciones que involucran haloalcanos. Para comprender mejor el mecanismo (una mirada detallada al proceso paso a paso a través del cual se produce una reacción), examinaremos de cerca la cloración del metano. Cuando se mezclan metano (CH 4) y cloro (Cl 2) en ausencia de luz a temperatura ambiente no pasa nada. Sin embargo, si se cambian las condiciones, de manera que o bien la reacción se está llevando a cabo a altas temperaturas (denotada por Δ) o hay irradiación ultra violeta, se forma un producto, clorometano (CH 3 Cl).
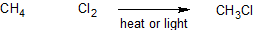
Energética
¿Por qué ocurre esta reacción? ¿Es favorable la reacción? Una forma de responder a estas preguntas es mirar el cambio en la entalpía (\(\Delta{H}\)) que se produce cuando se produce la reacción.
ΔH = (Energía puesta en reacción) — (Energía desprendida de la reacción)
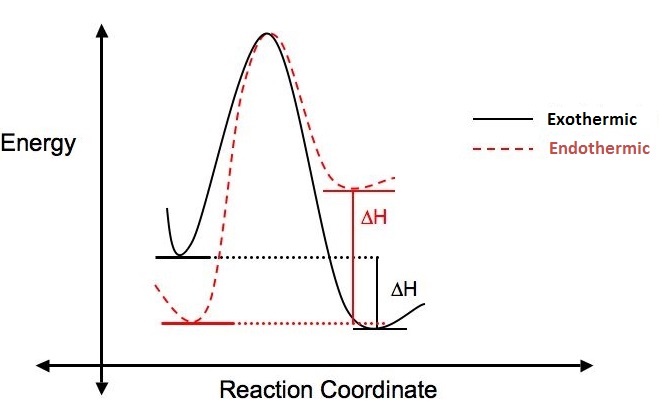
Si se pone más energía en una reacción de la que se emite, el ΔH es positivo, la reacción es endotérmica y no energéticamente favorable. Si en la reacción se desprende más energía de la que se puso, el ΔH es negativo, se dice que la reacción es exotérmica y se considera favorable. La siguiente figura ilustra la diferencia entre reacciones endotérmicas y exotérmicas.
ΔH también se puede calcular usando energías de disociación de enlace (ΔH°):
\[\Delta{H} = \sum \Delta{H^°} \text{ of bonds broken} - \sum \Delta{H^°} \text{ of bonds formed}\]
Veamos nuestro ejemplo específico de la cloración del metano para determinar si es endotérmico o exotérmico:
.jpg)
Dado que el ΔH para la cloración del metano es negativo, la reacción es exotérmica. Energéticamente esta reacción es favorable. Para entender mejor esta reacción necesitamos mirar el mecanismo (una mirada detallada paso a paso a la reacción que muestra cómo ocurre) por el cual ocurre la reacción.
Mecanismo de Cadena Radical
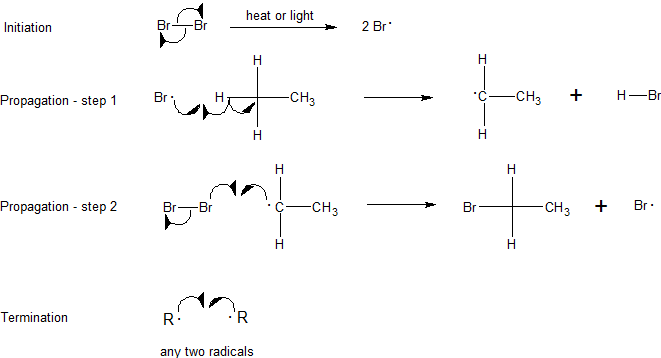
La reacción procede a través del mecanismo de cadena radical. El mecanismo de cadena radical se caracteriza por tres etapas: iniciación, propagación y terminación. La iniciación requiere un aporte de energía pero después de eso la reacción es autosustentable. El primer paso de propagación utiliza uno de los productos desde el inicio, y el segundo paso de propagación hace otro, así el ciclo puede continuar hasta indefinidamente.
Paso 1: Iniciación
La iniciación rompe el enlace entre la molécula de cloro (Cl 2). Para que este paso ocurra se debe poner energía, este paso no es energéticamente favorable. Después de esta etapa, la reacción puede ocurrir continuamente (siempre y cuando los reactivos proporcionen) sin aporte de más energía. Es importante señalar que esta parte del mecanismo no puede ocurrir sin algún aporte de energía externa, a través de la luz o el calor.
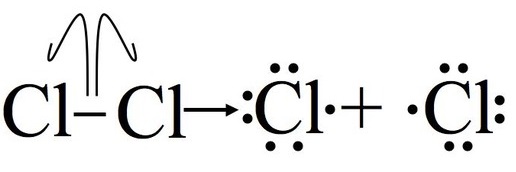
Paso 2: Propagación
Los siguientes dos pasos en el mecanismo se denominan pasos de propagación. En la primera etapa de propagación, un radical cloro se combina con un hidrógeno en el metano. Esto da ácido clorhídrico (HCl, el producto inorgánico de esta reacción) y el radical metilo. En la segunda etapa de propagación se usa más del material de partida de cloro (Cl 2), uno de los átomos de cloro se convierte en un radical y el otro se combina con el radical metilo.
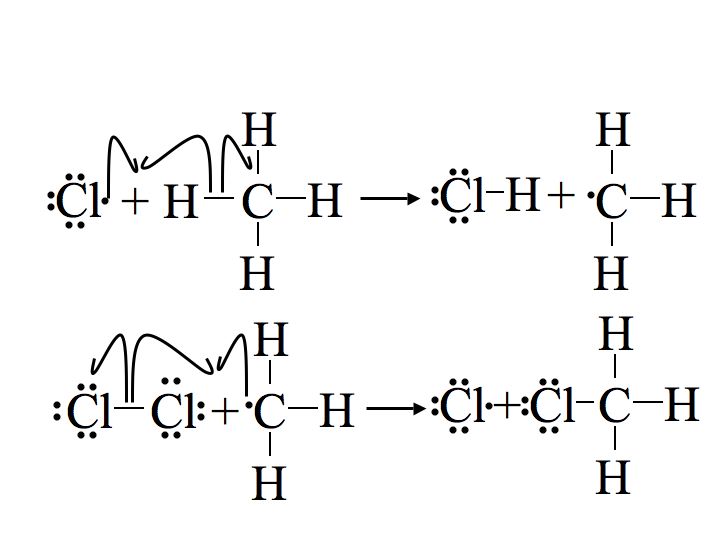
El primer paso de propagación es endotérmico, lo que significa que toma calor (requiere 2 kcal/mol) y no es energéticamente favorable. En contraste, la segunda etapa de propagación es exotérmica, liberando 27 kcal/mol. Una vez que se inicia la reacción, la energía exotérmica liberada de la segunda etapa de propagación proporciona la energía de activación para la primera etapa de propagación creando una reacción en cadena cíclica siguiendo el principio de Le Chatelier hasta la terminación.
.gif)
Paso 3: Terminación
En las etapas de terminación, todos los radicales restantes se combinan (de todas las maneras posibles) para formar más producto (CH 3 Cl), más reactivo (Cl 2) e incluso combinaciones de los dos radicales metilo para formar un producto secundario de etano (CH 3 CH 3).
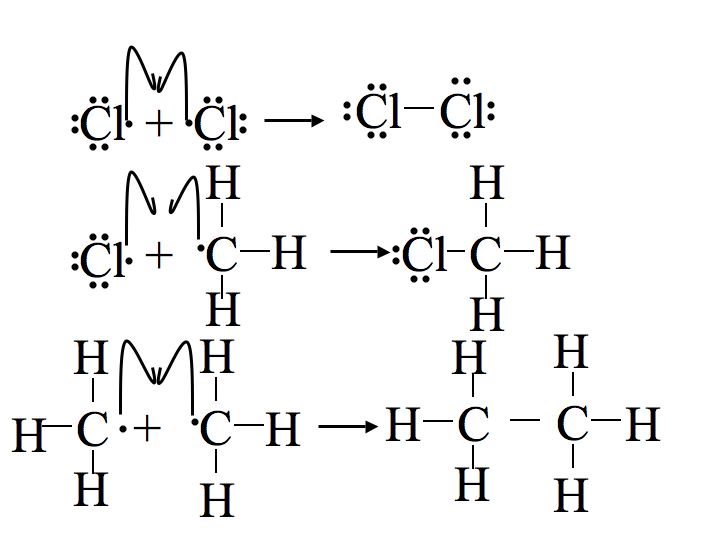
Limitaciones de la cloración
La cloración del metano o cualquier otro alcano no se detiene necesariamente después de una cloración. De hecho, puede ser muy difícil obtener un clorometano monosustituido. En cambio se forman di-, tri- e incluso tetra-clorometanos. Una forma de evitar este problema es usar una concentración mucho mayor de metano u otro alcano en comparación con el cloruro. Esto reduce la posibilidad de que un radical cloro entre en un clorometano y vuelva a comenzar el mecanismo para formar un diclorometano. A través de este método de control de las relaciones de producto uno es capaz de tener una cantidad relativa de control sobre el producto.
Ejercicios
- Los compuestos distintos del cloro y el metano pueden reaccionar a través de la halogenación por radicales libres. Escriba el mecanismo completo para la monobrominación del etano.
- Explique cómo el primer paso de propagación energéticamente desfavorable puede continuar ocurriendo sin la entrada de energía de una fuente externa.
- ¿Qué paso del mecanismo radical de la cadena requiere energía externa? ¿Qué se puede utilizar como esta energía?
- Utilice la tabla que se proporciona a continuación para calcular el cambio de entalpía para la monobrominación de etano.
| Compuesto | Energía de disociación de enlace (kcal/mol) |
| CH 3 CH 2 -H | 101 |
| CH 3 CH 2 -Br | 70 |
| H-Br | 87 |
| Br 2 | 46 |
Soluciones
1.
2. La energía exotérmica liberada de la segunda etapa de propagación proporciona la energía de activación para la primera etapa de propagación creando una reacción en cadena cíclica siguiendo el principio de Le Chatelier hasta la terminación.
3. El paso de iniciación requiere energía del calor o encendido. Para una máxima fotoeficiencia, la longitud de onda de la luz se correlaciona con el enlace que se escinde homolíticamente.
4. 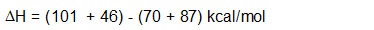
Referencias
- Matyjaszewski, Krzysztof, Wojciech Jakubowski, Ke Min, Wei Tang, Jinyu Huang, Wade A. Braunecker y Nicolay V. Tsarevsky. “Disminución de la Concentración de Catalizador en la Polimerización Radical de Transferencia Ciencia 72 (1930): 379-90.
- Phillips, Francis C. “# Investigaciones sobre las Propiedades Químicas de los Gases.” Investigaciones sobre las Propiedades Químicas de los Gases 17 (1893): 149-236.
Enlaces externos
- Video del Mecanismo: http://www.jbpub.com/organic-online/movies/chlormet.htm
- Wikipedia de Mecanismo de Cadena Radical: es.wikipedia.org/wiki/Free_Radical_halogenation
- Wikipedia del Principio de Le Chatelier: es.wikipedia.org/wiki/Le_Chatelier%27S_Principio #Concentration
Colaboradores y Atribuciones
- Kristen Kelley y Britt Farquharson

