7.1: Halouros de alquilo - Estructura y Propiedades Físicas
- Page ID
- 76246
Objetivo de aprendizaje
- clasificar haluros de alquilo
- predecir puntos de ebullición relativos y solubilidad de haluros de alquilo
Introducción
Los haluros de alquilo también se conocen como haloalcanos. Los haluros de alquilo son compuestos en los que uno o más átomos de hidrógeno en un alcano han sido reemplazados por átomos de halógeno (flúor, cloro, bromo o yodo). Solo veremos compuestos que contienen un átomo de halógeno como los siguientes compuestos.
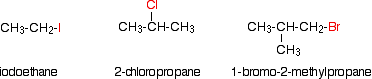
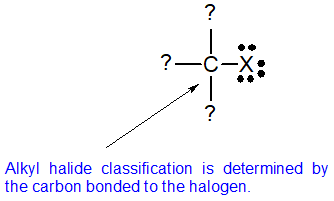
Los haluros de alquilo caen en diferentes clases dependiendo de cómo se posicione el átomo de halógeno en la cadena de átomos de carbono. Los haluros de alquilo se pueden clasificar como primarios, secundarios o terciarios. La reactividad química de los haluros de alquilo se discute frecuentemente usando clasificaciones de haluros de alquilo para ayudar a discernir patrones y tendencias. Debido a que el patrón de unión neutra para los halógenos es un enlace y tres pares solitarios, el carbono y el halógeno siempre comparten un enlace sencillo. La clasificación de haluros de alquilo está determinada por el patrón de unión del átomo de carbono unido al halógeno como se muestra en el diagrama a continuación.
Halouros de alquilo primarios
En un haloalcano primario (1°), el carbono unido al átomo de halógeno solo está unido a otro grupo alquilo. Algunos ejemplos de haluros de alquilo primarios incluyen los siguientes compuestos.
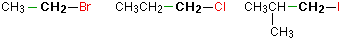
Observe que no importa lo complicado que sea el grupo alquilo unido. En cada caso solo hay un enlace a un grupo alquilo del grupo CH 2 que contiene el halógeno. Hay una excepción a esto: CH 3 Br y los otros haluros de metilo a menudo se cuentan como haluros de alquilo primarios a pesar de que no hay grupos alquilo unidos al carbono con el halógeno en él.
Haluros de alquilo secundarios
En un haloalcano secundario (2°), el carbono unido con el átomo de halógeno se une directamente a otros dos grupos alquilo que pueden ser iguales o diferentes. Algunos ejemplos de haluros de alquilo secundarios incluyen los siguientes compuestos.
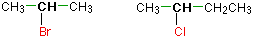
Halouros de alquilo terciario
En un halogenoalcano terciario (3°), el átomo de carbono que contiene el halógeno está unido directamente a tres grupos alquilo, los cuales pueden ser cualquier combinación igual o diferente. Algunos ejemplos de haluros de alquilo terciario incluyen los siguientes compuestos.
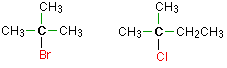
Nombres Comunes
Muchos compuestos orgánicos están estrechamente relacionados con los alcanos y esta similitud se incorpora en muchos nombres comunes. Las reacciones de alcanos con halógenos producen hidrocarburos halogenados, compuestos en los que uno o más átomos de hidrógeno de un hidrocarburo han sido reemplazados por átomos de halógeno: La sustitución de un solo átomo de hidrógeno da un haluro de alquilo (o haloalcano). Los nombres comunes de haluros de alquilo constan de dos partes: el nombre del grupo alquilo más el tallo del nombre del halógeno, con el final -ide.
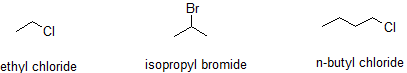
Ejemplos
Dar los nombres comunes e IUPAC para cada compuesto.
- CH 3 CH 2 CH 2 Br
- (CH 3) 2 CHCl
- Dar el nombre de la IUPAC para cada compuesto.
a)
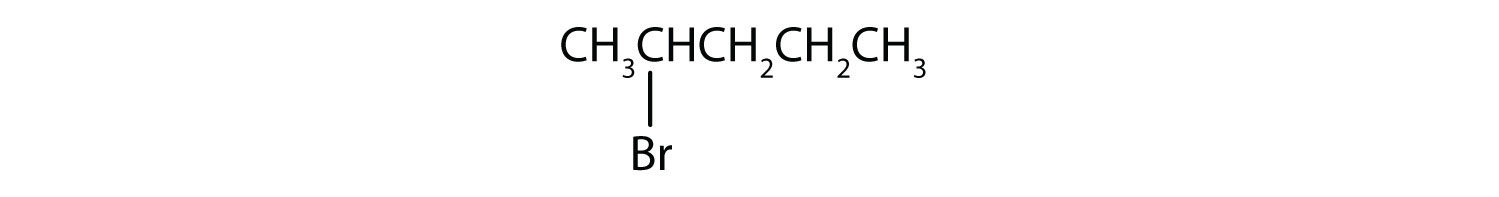 b)
b)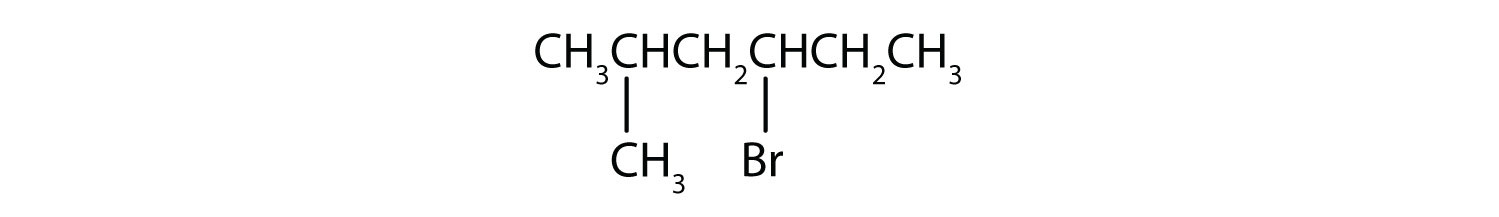
SOLUCIONES
- El grupo alquilo (CH 3 CH 2 CH 2 —) es un grupo propilo, y el halógeno es bromo (Br). El nombre común es por lo tanto bromuro de propilo. Para el nombre de la IUPAC, el prefijo para bromo (bromo) se combina con el nombre de una cadena de tres carbonos (propano), precedido por un número que identifica el átomo de carbono al que está unido el átomo de Br, por lo que el nombre de la IUPAC es 1-bromopropano.
- El grupo alquilo [(CH 3) 2 CH—] tiene tres átomos de carbono, con un átomo de cloro (Cl) unido al átomo de carbono medio. El grupo alquilo es, por lo tanto, isopropilo, y el nombre común del compuesto es cloruro de isopropilo. Para el nombre de la IUPAC, el átomo de Cl (prefijo cloro -) unido al átomo de carbono medio (segundo) de una cadena de propano da como resultado 2-cloropropano.
- a) El alcano parental tiene cinco átomos de carbono en la cadena continua más larga; es pentano. Un grupo bromo (Br) está unido al segundo átomo de carbono de la cadena. El nombre de la IUPAC es 2-bromopentano.
b) El alcano progenitor es hexano. Los grupos metilo (CH 3) y bromo (Br) están unidos al segundo y cuarto átomos de carbono, respectivamente. Listar los sustituyentes en orden alfabético da el nombre 4-bromo-2-metilhexano.
Ejercicio
1. Dar nombres comunes e IUPAC para cada compuesto.
- CH 3 CH 2 I
- CH 3 CH 2 CH 2 CH 2 F
2. Dar el nombre de la IUPAC para cada compuesto.
a)
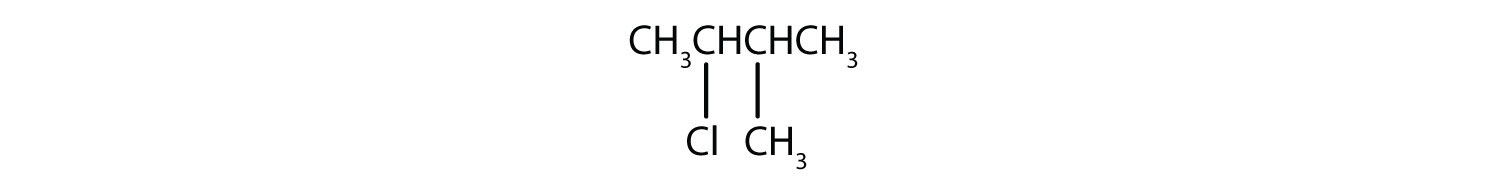
b)
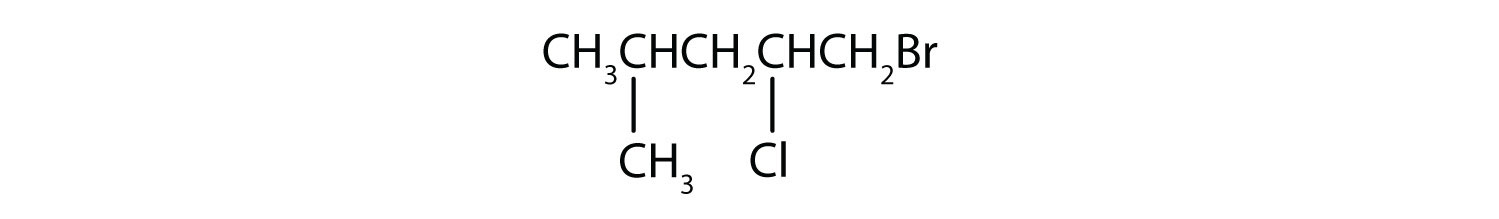
- Contestar
-
1. a) yoduro de etilo y yodoetano, respectivamente; Obsérvese que el nombre de la IUPAC no necesita un número localizador porque solo hay una estructura posible con dos carbonos y un yodo.
b) fluoruro de butilo y 1-fluorobutano
2. a) 2-cloro-2-metilbutano
b) 1-bromo-2-cloro-4-metilpentano
Halógenos y el Carácter del Enlace Carbono-Halógeno
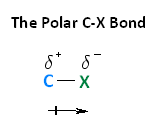
Con respecto a la electronegatividad, los halógenos son más electronegativos que los carbonos. Esto da como resultado un enlace carbono-halógeno que está polarizado. Como se muestra en la imagen de abajo, el átomo de carbono tiene una carga positiva parcial, mientras que el halógeno tiene una carga negativa parcial.
La siguiente imagen muestra la relación entre los halógenos y la electronegatividad. Observe, a medida que avanzamos en la tabla periódica del yodo al flúor, aumenta la electronegatividad.
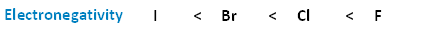
La siguiente imagen muestra las relaciones entre la longitud del enlace, la fuerza de unión y el tamaño molecular. A medida que avanzamos por la tabla periódica de flúor a yodo, el tamaño molecular aumenta. Como resultado, también vemos un aumento en la longitud del enlace. Por el contrario, a medida que aumenta el tamaño molecular y obtenemos enlaces más largos, la fuerza de esos enlaces disminuye.

Los haloalcanos tienen puntos de ebullición más altos que los alcanos
Al comparar alcanos y haloalcanos, veremos que los haloalcanos tienen puntos de ebullición más altos que los alcanos que contienen el mismo número de carbonos. Las fuerzas de dispersión londinenses son las primeras de dos tipos de fuerzas que contribuyen a esta propiedad física. Tal vez recuerde de la química general que las fuerzas de dispersión de Londres aumentan con el área de superficie molecular. Al comparar haloalcanos con alcanos, los haloalcanos presentan un incremento en la superficie debido a la sustitución de un halógeno por hidrógeno. El aumento de la superficie provoca un aumento de las fuerzas de dispersión de Londres, lo que luego resulta en un punto de ebullición más alto.
La interacción dipolo-dipolo es el segundo tipo de fuerza que contribuye a un mayor punto de ebullición. Como recordarás, este tipo de interacción es una atracción coulómbica entre las cargas positivas parciales y negativas parciales que existen entre los enlaces carbono-halógeno en moléculas de haloalcano separadas. Similar a las fuerzas de dispersión de Londres, las interacciones dipolo-dipolo establecen un punto de ebullición más alto para los haloalcanos en comparación con los alcanos con el mismo número de carbonos.
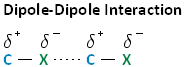
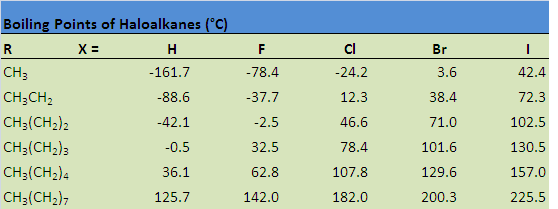
La siguiente tabla ilustra cómo los puntos de ebullición se ven afectados por algunas de estas propiedades. Observe que el punto de ebullición aumenta cuando el hidrógeno es reemplazado por un halógeno, consecuencia del aumento en el tamaño molecular, así como un aumento tanto en las fuerzas de dispersión de Londres como en las atracciones dipolo-dipolo. El punto de ebullición también aumenta como resultado de aumentar el tamaño del halógeno, así como aumentar el tamaño de la cadena de carbono.
Solubilidad
Solubilidad en agua
Los haluros de alquilo tienen poca o ninguna solubilidad en agua a pesar del enlace polar carbono-halógeno. La atracción entre las moléculas de haluro de alquilo es más fuerte que la atracción entre el haluro de alquilo y el agua. Los haluros de alquilo tienen poca o ninguna solubilidad en agua, pero tenga en cuenta las densidades. Los alcanos polihalogenados como el diclorometano pueden tener densidades mayores que el agua.
Solubilidad en disolventes orgánicos
Los haluros de alquilo son solubles en la mayoría de los solventes orgánicos. Las fuerzas de dispersión de Londres juegan un papel dominante en la solubilidad.
Ejercicios
Ejercicio
3. Clasificar (primario, secundario, terciario, vecinal o geminal) y dar el nombre de la IUPAC para los siguientes organohaluros:

4. Clasifique (primaria, secundaria, terciaria, vecinal o geminal) y dibuje las estructuras de la línea de unión de los siguientes compuestos:
a) 2-Cloro-3,3-dimetilpentano
b) 1,1-dicloro-4-isopropilciclohexano
c) 3-bromo-3-etilhexano
5. Disponer los siguientes haluros de alquilo en orden de punto de ebullición decreciente.
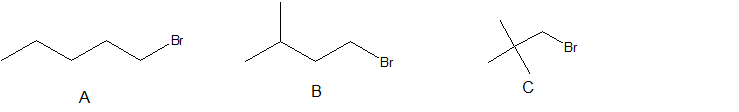
-
6. Predecir el disolvente con gran solubilidad de haluro de alquilo.
-
a) agua o hexano
b) agua o 1-octanol
c) agua o benceno
d) agua o acetona
- Soluciones
-
3.
a) secundario; 5-etil-4-yodo-3metil-octano
b) primario; 1-bromo-2,3,4-trimetil-pentano
c) dihaluro vecinal; 4-bromo-5-cloro-2-metil-heptano
4. (A) secundario; (B) dicloruro geminal (C) terciario
.png)
5. A > B > C
6.
a) hexano
b) benceno
c) 1-octanol
d) acetona
Los haluros de alquilo tienen poca o ninguna solubilidad en agua, pero tenga en cuenta las densidades. Los alcanos polihalogenados pueden tener densidades mayores que el agua.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Jim Clark (Chemguide.co.uk)
- Rachael Curtis (UC Davis)

