7.15: Características de la Reacción E1
- Page ID
- 76188
Objetivo de aprendizaje
- determinar la ley de velocidad y predecir el mecanismo basado en su ecuación de velocidad o datos de reacción para reacciones E1
- predecir los productos y especificar los reactivos para las reacciones E1 con estereoquímica
- proponer mecanismos para reacciones E1
- dibujar e interpretar diagramas de energía de reacción para reacciones E1
Reacción General
La eliminación unimolecular (E1) es una reacción en la que la pérdida del grupo lábil seguida de la eliminación del beta-hidrógeno da como resultado la formación de un doble enlace.
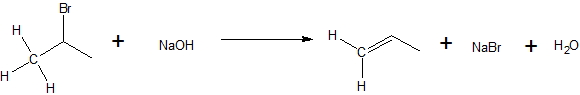
Es similar a una reacción de sustitución nucleofílica unimolecular (S N 1) de diversas maneras. Uno de ellos es la formación de un carbocatión intermedio como el paso determinante de la velocidad (lento), de ahí el nombre unimolecular. . Los haluros de alquilo que pueden ionizarse para formar carbocationes estables son más reactivos a través del mecanismo E1. Debido a que la estabilidad de los carbocationes es la consideración energética principal, la estabilización del carbocatión por solvatación también es una consideración importante. Debido a que los carbocationes son altamente reactivos, la fuerza de la base no es importante y se pueden usar bases débiles. S ince S N 1 y E1 reacciones se comportan de manera similar, a menudo compiten entre sí. Muchas veces, ambas reacciones ocurrirán simultáneamente para formar diferentes productos a partir de una sola reacción. Sin embargo, uno puede ser favorecido sobre otro a través del control termodinámico. El calentamiento de la reacción favorece la eliminación sobre la sustitución.
En orden de importancia decreciente, los factores que impactan las vías de reacción de E1 son
1) estructura del haluro de alquilo
2) estabilidad del carbocatión
3) tipo de solvente
4) fuerza de la base.
Mecanismo para haluros de alquilo
Como se puede apreciar en el mecanismo E1 a continuación, el paso preliminar es que el grupo de salida (LG) salga por su cuenta. Debido a que lleva los electrones en el enlace junto con él, el carbono que estaba unido a él pierde su electrón, convirtiéndolo en un carbocatión. Una vez que se convierte en un carbocatión, una Base de Lewis (B -) desprotonata el carbocatión intermedi en la posición beta, que luego dona sus electrones al enlace C-C vecino para formar un doble enlace. A diferencia de las reacciones E2, que requieren que el protón sea anti al grupo lábil, las reacciones E1 solo requieren un hidrógeno vecino. Esto se debe a que el grupo saliente ya dejó la molécula. El producto final es un alqueno junto con el subproducto HB y la sal del grupo lábil.
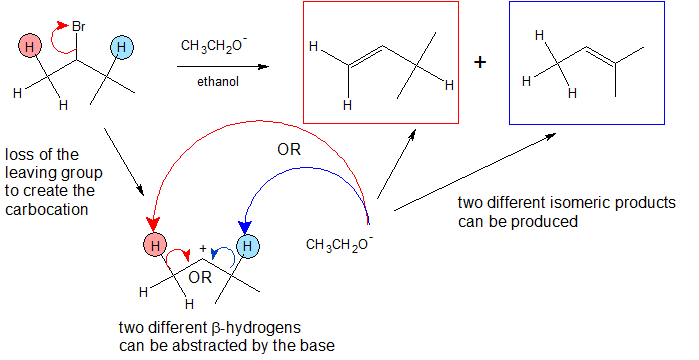
Una vez más, vemos los dos pasos del mecanismo E1.
- Una base desprotonata un carbono beta para formar un enlace pi.
En este caso vemos una mezcla de productos en lugar de uno discreto. Este es el caso porque el carbocatión tiene dos carbonos cercanos que son capaces de ser desprotonados, pero que solo uno forma un producto principal (más estable).
Reactividad
Debido a que las reacciones E1 producen un carbocatión intermedio, las reglas presentes en\(S_N1\) reactions still apply.
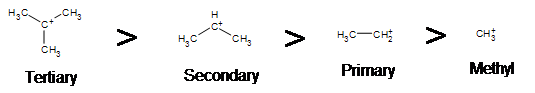
Como era de esperar, los carbocationes terciarios se ven favorecidos sobre los secundarios, primarios y metílicos, debido a los fenómenos de hiperconjugación, que esencialmente permiten un enlace C-C o C-H cercano a interactúan con el orbital p del carbono para llevar los electrones a un estado de menor energía. Así, esto tiene un efecto estabilizador sobre la molécula en su conjunto. En general, los carbocationes primarios y metílicos no proceden por la vía E1 por esta razón, a menos que exista una media s de reordenamiento de carbocationes para mover la carga positiva a un carbono cercano. Los carbonos secundarios y terciarios forman carbocationes más estables, por lo que esta formación se produce con bastante rapidez.
Los carbocationes secundarios pueden estar sujetos a la vía de reacción E2, pero esto generalmente ocurre en presencia de una base buena/fuerte. Agregar una base débil a la reacción desfavorece a E2, empujando esencialmente hacia la vía E1. En muchos casos, la solvolisis ocurre en lugar de usar una base para desprotonar. Esto significa que se agrega calor a la solución, y el propio disolvente desprotonata un hidrógeno. El medio también puede afectar la vía de la reacción. Los solventes próticos polares pueden ser utilizados para impedir nucleófilos, desfavoreciendo así la ocurrencia de E2/S n 2.
Regioquímica y Estereoquímica de la Reacción E1
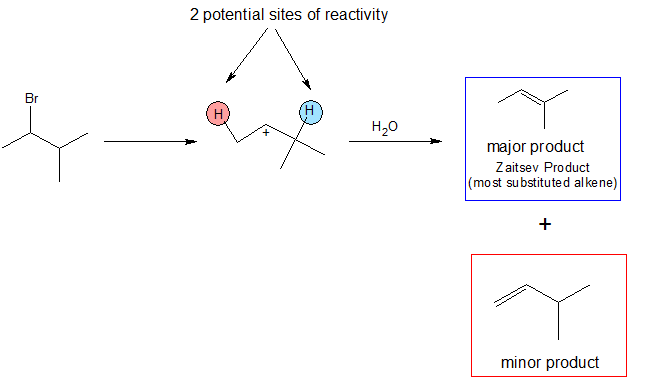
La reacción E1 es regioespecífica porque sigue la regla de Zaitsev que establece que el alqueno más sustituido es el producto principal. Esto infiere que el hidrógeno en el carbono más sustituido es el más probable de ser desprotonado, permitiendo así que se forme el alqueno más sustituido.
A diferencia de las reacciones E2, la reacción E1 no es estereoespecífica. Por lo tanto, no se requiere que un hidrógeno sea anticoplanario al grupo de salida porque el grupo de salida se ha ido. En el siguiente mecanismo, podemos ver dos posibles vías para la reacción. Cualquiera de los dos conduce a un producto resultante plausible, sin embargo, solo uno forma un producto principal. Como lo afirma la regla de Zaitsev, la desprotonación del carbono más sustituido da como resultado el alqueno más sustituido. Este entonces se convierte en el producto más estable debido a la hiperconjugación, y también es más común que el producto menor.
Ejercicios
- ¿Cuál de estos pasos es el paso determinante de la tasa (A o B)?
¿Cuál es el producto principal formado (C o D)?
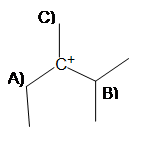
2. Para producir el producto alqueno más estable, ¿a partir de qué carbono debe desprotonarse la base (A, B o C)?
Si el carbocatión se reorganizara, ¿sobre qué carbono iría la carga positiva sin sacrificar la estabilidad (A, B o C)?
3) Predecir el producto principal de la siguiente reacción.
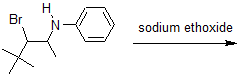
4) (Verdadero o Falso) — No hay forma de controlar la relación de producto de las reacciones E1/S n 1.
5) Explicar por qué la presencia de una base débil/nucleófilo favorece las reacciones E1 sobre E2.
- Responder
-
1. A, C
2. B, B
3.
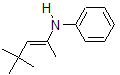
4. Falso - Se pueden controlar termodinámicamente para favorecer un determinado producto sobre otro.
5. Por definición, una reacción E1 es una reacción de Eliminación Unimolecular. Esto significa que la única etapa determinante de la velocidad es la de la disociación del grupo lábil para formar un carbocatión. Dado que E2 es bimolecular y el ataque nucleofílico forma parte del paso determinante de la velocidad, una base débil/nucleófilo lo desfavorece y finalmente permite que E1 domine. (No te olvides del S N 1 que todavía pertenece a esta reacción simaltáneamente).
Enlaces externos
- Antecedentes de la reacción E1: http://en.Wikipedia.org/wiki/E1_elimination
Fuentes externas
- McMurry, J., Simanek, E. Fundamentos de Química Orgánica, 6ª edición. Cengage Learning, 2007.
Colaboradores
- Satish Balasubramaniano


