7.16: Regioquímica E2 y conformaciones de ciclohexano
- Page ID
- 76273
Objetivo de aprendizaje
- usar la regla de Zaitsev para predecir productos mayores y menores de reacciones de eliminación incluyendo halociclohexanos
Conformación de ciclohexano y orientación anticoplanar
El mecanismo concertado de la reacción E2 requiere que el grupo base y saliente estén orientados anticoplanares entre sí. Cuando el beta-hidrógeno y el grupo saliente (haluro para este capítulo) se localizan en un anillo de 6 miembros, entonces no podrá seguirse la Regla de Zaitsev. El beta-hidrógeno y el grupo saliente deben estar ambos en la posición axial para que se produzca la reacción E2. En consecuencia, las reacciones E2 de ciertos haluros de cicloalquilo muestran tasas inusuales y regioselectividad que no son explicadas por los principios discutidos hasta ahora. Por ejemplo, el trans-2-metil-1-clorociclohexano reacciona con KOH alcohólico a una velocidad mucho más lenta que su isómero cis. Además, el producto de la eliminación del isómero trans es 3-metilciclohexeno (no predicho por la regla de Zaitsev), mientras que el isómero cis da el 1-metilciclohexeno predicho como producto principal. Estas diferencias son descritas por las dos primeras ecuaciones en el siguiente diagrama.
A diferencia de las estructuras de cadena abierta, los compuestos cíclicos generalmente restringen la orientación espacial de los sustituyentes del anillo a relativamente pocas disposiciones En consecuencia, las reacciones realizadas sobre dichos sustratos a menudo nos proporcionan información sobre la orientación preferida de las especies reaccionantes en el estado de transición. Los estereoisómeros son particularmente adecuados a este respecto, por lo que los resultados aquí mostrados contienen información importante sobre el estado de transición E2.
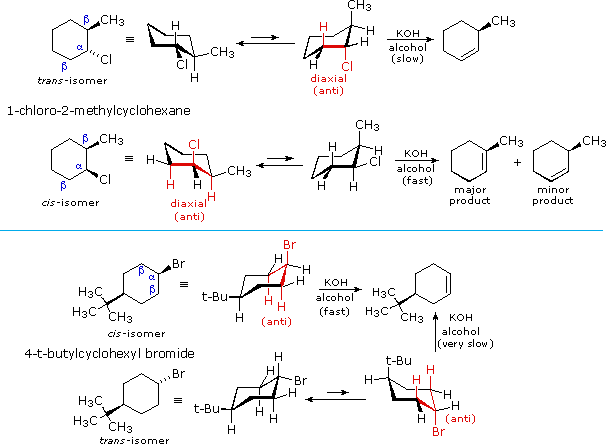
La interpretación más sensata de las reacciones de eliminación de halociclohexanos 2 y 4 sustituidos es que esta reacción prefiere una anti orientación del halógeno y el beta-hidrógeno que es atacado por la base. Estas anti orientaciones están coloreadas en rojo en las ecuaciones anteriores. Todos los compuestos utilizados aquí tienen anillos de seis miembros, por lo que la anti orientación de los grupos requiere que asuman una conformación diaxial. Las diferencias observadas en la velocidad son el resultado de una preferencia estérica por la orientación ecuatorial de sustituyentes grandes, lo que reduce la concentración efectiva de confórmeros que tienen un halógeno axial. En el caso de los isómeros 1-bromo-4-terc-butilciclohexano, el grupo terc-butilo es tan grande que siempre asumirá una orientación ecuatorial, dejando que el bromo sea axial en el isómero cis y ecuatorial en el trans. Debido a la simetría, los dos beta-hidrógenos axiales en el isómero cis reaccionan por igual con la base, resultando en una rápida eliminación al mismo alqueno (en realidad una mezcla racémica). Esto refleja la anti orientación fija de estos hidrógenos al átomo de cloro. Para asumir una conformación que tenga un bromo axial, el isómero trans debe tolerar graves distorsiones de hacinamiento. Por lo tanto, dichos confórmeros están presentes en concentraciones extremadamente bajas, y la velocidad de eliminación es muy lenta. En efecto, predomina la sustitución por anión hidróxido.
 Un análisis similar de los isómeros del 1-cloro-2-metilciclohexano explica las diferencias tanto de velocidad como de regioselectividad. Tanto los grupos cloro como metilo pueden asumir una orientación ecuatorial en una conformación de silla del isómero trans, como se muestra en la ecuación superior. El cloro axial necesario para la eliminación de E2 está presente solo en el conformador de silla alternativo menos estable, pero esta estructura tiene solo un beta-hidrógeno axial (coloreado rojo), y la eliminación resultante da 3-metilciclohexeno. En el isómero cis, el átomo de cloro más pequeño asume una posición axial en la conformación de silla más estable, y aquí hay dos hidrógenos beta axiales. El 1-metilciclohexeno más estable es por lo tanto el producto predominante, y la tasa global de eliminación es relativamente rápida.
Un análisis similar de los isómeros del 1-cloro-2-metilciclohexano explica las diferencias tanto de velocidad como de regioselectividad. Tanto los grupos cloro como metilo pueden asumir una orientación ecuatorial en una conformación de silla del isómero trans, como se muestra en la ecuación superior. El cloro axial necesario para la eliminación de E2 está presente solo en el conformador de silla alternativo menos estable, pero esta estructura tiene solo un beta-hidrógeno axial (coloreado rojo), y la eliminación resultante da 3-metilciclohexeno. En el isómero cis, el átomo de cloro más pequeño asume una posición axial en la conformación de silla más estable, y aquí hay dos hidrógenos beta axiales. El 1-metilciclohexeno más estable es por lo tanto el producto predominante, y la tasa global de eliminación es relativamente rápida.
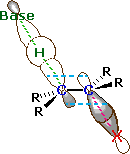
A la derecha se muestra un dibujo orbital del estado antitransición. Obsérvese que la base ataca al haluro de alquilo desde el lado opuesto al halógeno, al igual que en el mecanismo S N 2. En este dibujo los átomos de carbono α y β están experimentando una rehibridación de sp 3 a sp 2 y el enlace π en desarrollo se dibuja como líneas discontinuas de color azul claro. El símbolo R representa un grupo alquilo o hidrógeno. Dado que tanto la base como el haluro de alquilo están presentes en este estado de transición, la reacción es bimolecular y debe exhibir cinética de segundo orden. Debemos señalar de paso que un estado de transición de sincronización también proporcionaría un buen solapamiento orbital para su eliminación, y en algunos casos donde una antiorientación está prohibida por restricciones estructurales se ha observado la eliminación de syn.
Cadenas de haluro de alquilo
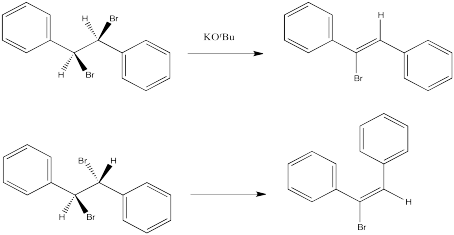
En cambio, en una reacción E2, la estereoquímica del doble enlace —es decir, si resulta el isómero E o Z — viene dictada por la estereoquímica del material de partida, si es diastereomérico. En otras palabras, si el carbono con el hidrógeno y el carbono con el halógeno son ambos quirales, entonces un diastereómero conducirá a un producto, y el otro diastereómero conducirá al otro producto.
Las siguientes reacciones de etóxido de potasio con dibromoestilbeno (1,2-dibromo-1,2-difeniletano) ocurrieron a través de un mecanismo E2. Se utilizaron dos diastereómeros diferentes. Resultaron dos estereoisómeros diferentes (E vs. Z).
Ejercicio
1. ¿Cuál de los siguientes compuestos reaccionará más rápido en una reacción E2; trans -1-bromo-2-isopropilciclohexano o cis -1-bromo-2-isopropilciclohexano?
- Contestar
-
1. El isómero cis reaccionará más rápido que el trans. El isómero cis tiene dos posibles hidrógeno perpendiculares en los que puede eliminar de.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

