7.20: Reacciones de Sustitución Biológica
- Page ID
- 76261
Objetivo
- discutir la importancia de los grupos salientes en las reacciones de sustitución biológica
Grupos Dejando en Reacciones Bioquímicas
En las reacciones biológicas, no solemos ver haluros que sirvan como grupos salientes (de hecho, fuera de algunos organismos marinos, los halógenos son bastante inusuales en las moléculas biológicas). Los grupos salientes más comunes en las reacciones bioquímicas son los fosfatos, el agua, los alcoholes y los tioles. En muchos casos, el grupo lábil es protonado por un grupo ácido en la enzima a medida que se produce la ruptura del enlace. Por ejemplo, el ion hidróxido en sí mismo rara vez actúa como un grupo de salida —simplemente es demasiado alto en energía (demasiado básico). Más bien, el oxígeno hidróxido generalmente es protonado por un ácido enzimático antes o durante el evento de ruptura del enlace, dando como resultado un grupo de salida de agua (muy estable).
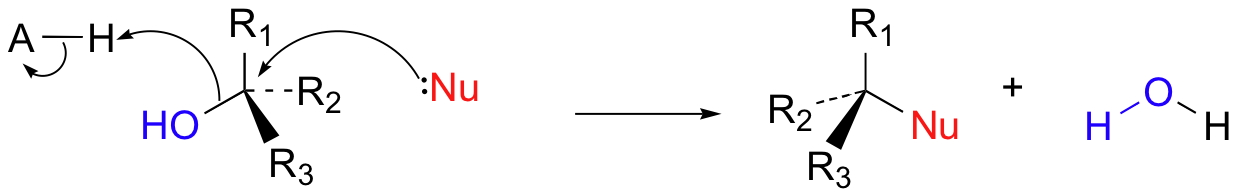
Más a menudo, sin embargo, el grupo hidroxilo de un alcohol se convierte primero enzimáticamente en un éster de fosfato con el fin de crear un mejor grupo lábil. Este éster de fosfato puede tomar la forma de un monofosfato simple (flecha 1 en la figura siguiente), un difosfato (flecha 2) o un nucleótido monofosfato (flecha 3).
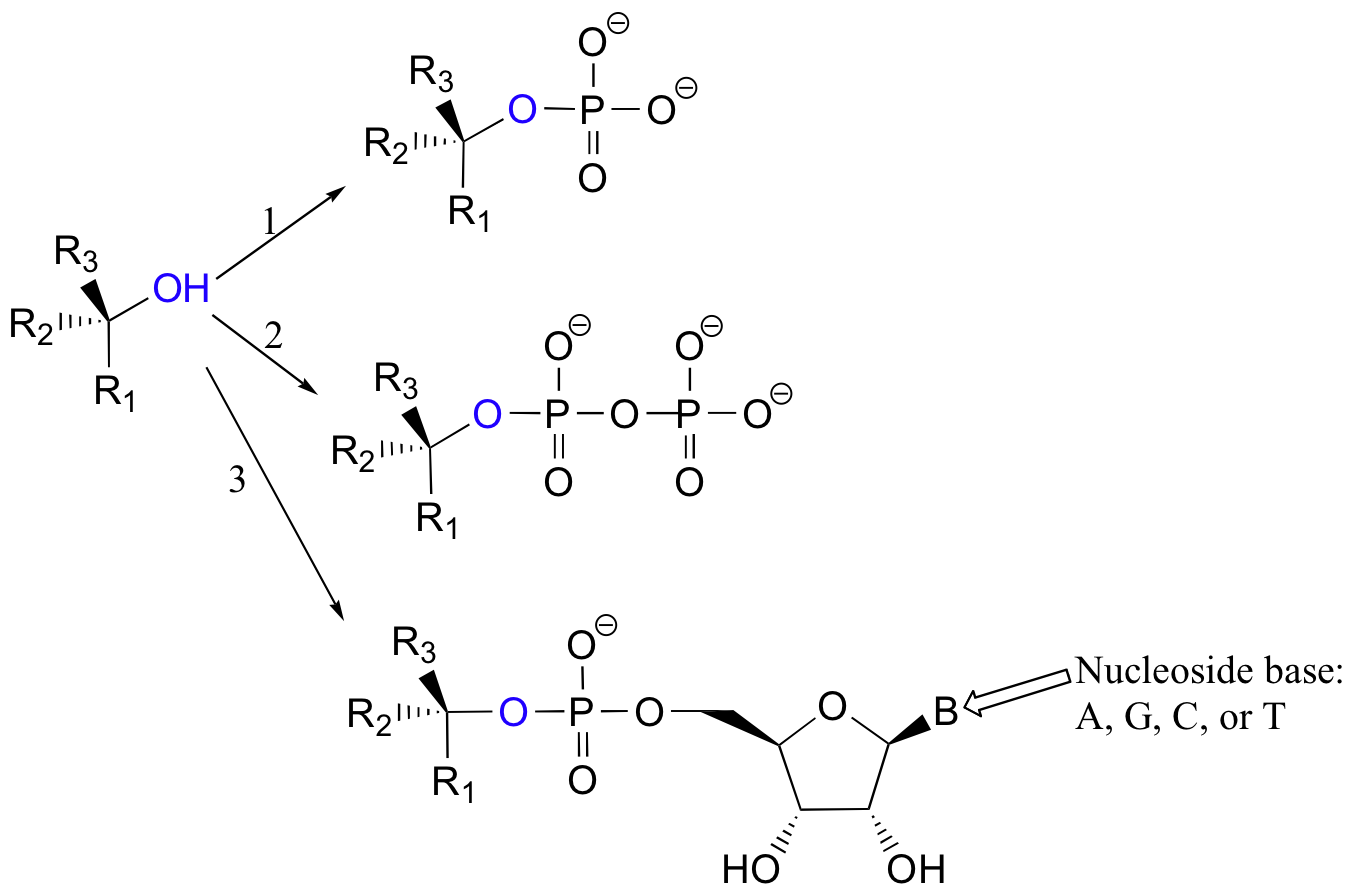
Debido a la deslocalización por resonancia de la carga negativa en desarrollo, los fosfatos son excelentes grupos de salida.

Aquí hay un ejemplo específico (de la biosíntesis de nucleótidos de ADN):
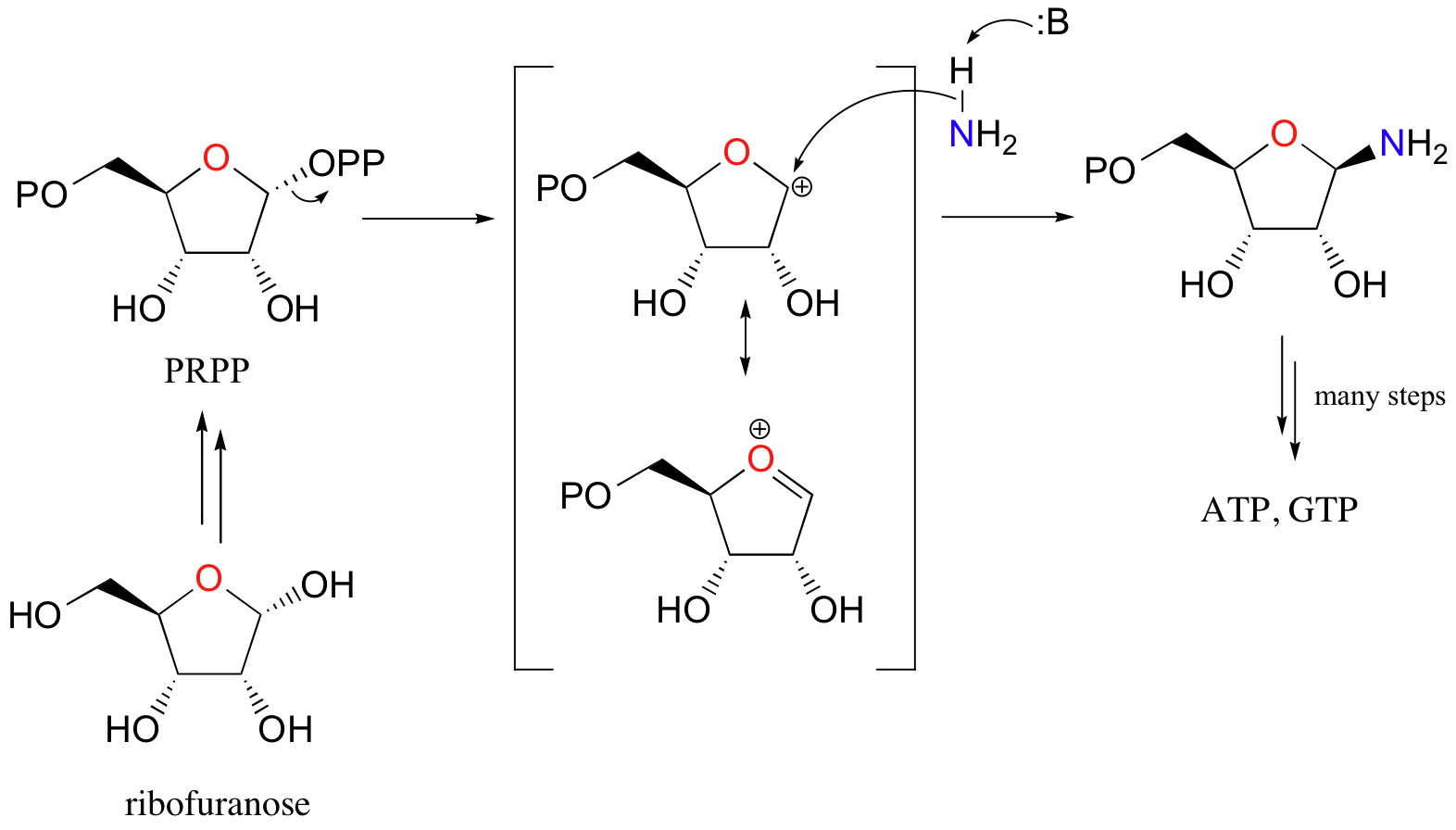
Aquí, el grupo OH en la ribofuranosa se convierte en un difosfato, un grupo saliente mucho mejor. El amoníaco es el nucleófilo en la segunda etapa de esta reacción tipo S N 1.
Lo importante por ahora es que en cada caso, un alcohol se haya convertido en un grupo saliente mucho mejor, y ahora está cebado para una reacción de sustitución nucleofílica.
SAM Metiltransferasas
Algunos de los ejemplos más importantes de reacciones de S N 2 en bioquímica son las catalizadas por enzimas metiltransferasa dependientes de S-adenosil metionina (SAM). Ya hemos visto, en el capítulo 6 y nuevamente en el capítulo 8, cómo se transfiere un grupo metilo en una reacción S N 2 de SAM al grupo amina en la base nucleotídica adenosina:
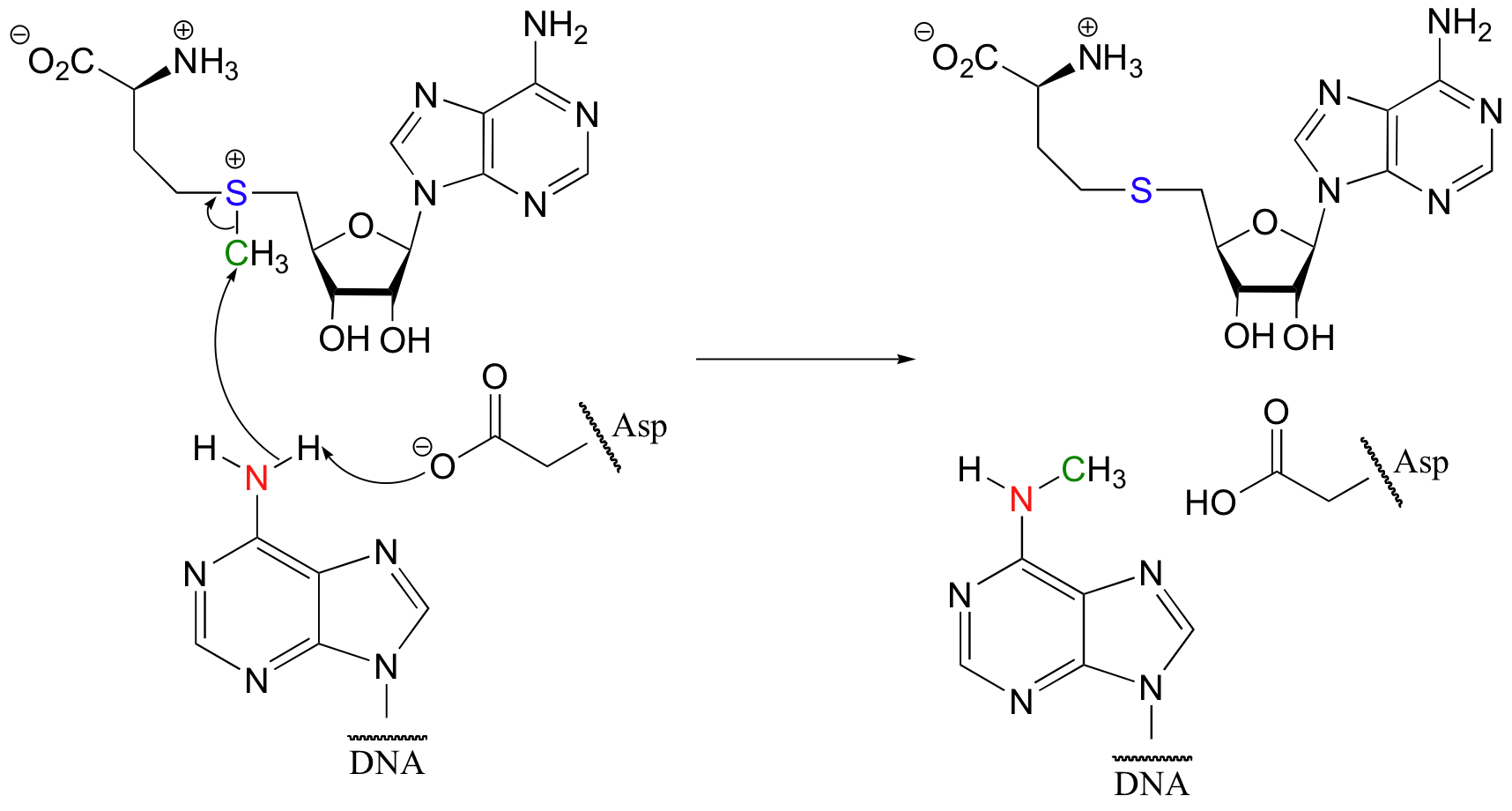
(Ácidos Nucleicos Res. 2000, 28, 3950).
Otra reacción de metilación dependiente de SAM es catalizada por una enzima llamada catecol-O-metiltransferasa. El sustrato aquí es la epinefrina, también conocida como adrenalina.
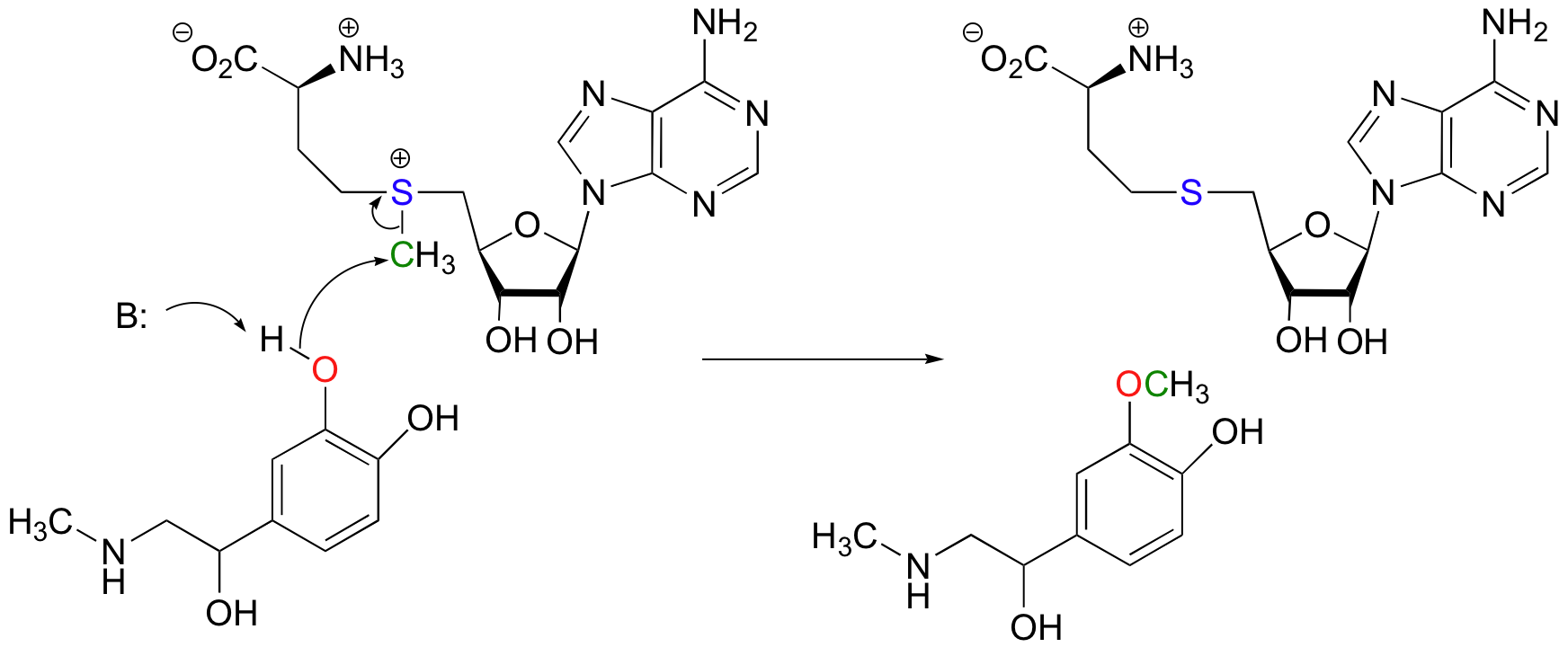
Observe que en este ejemplo, el nucleófilo atacante es un alcohol más que una amina (por eso la enzima se llama O-metiltransferasa). En ambos casos, sin embargo, una cadena lateral de aminoácidos básicos se posiciona en el sitio activo en el lugar justo para desprotonar el grupo nucleófilo a medida que ataca, aumentando su nucleofilia. El electrófilo en ambas reacciones es un carbono metílico, por lo que hay poco obstáculo estérico para frenar el ataque nucleofílico. El carbono metílico es electrófilo porque está unido a un azufre cargado positivamente, que es un poderoso grupo atrayente de electrones. La carga positiva sobre el azufre también lo convierte en un excelente grupo de salida, ya que el producto resultante será un sulfuro neutro y muy estable. Con todo, en ambas reacciones tenemos un nucleófilo razonablemente bueno, un electrófilo pobre en electrones, sin obstáculos y un excelente grupo lábil.
Debido a que el carbono electrófilo en estas reacciones es un carbono metílico, un mecanismo escalonado similar al S N 1 es extremadamente improbable: un carbocatión de metilo es muy alto en energía y por lo tanto no es un intermedio razonable para proponer. Podemos predecir con confianza que esta reacción es S N 2. ¿Se produce esta reacción de S N 2, como se esperaba, con inversión de la estereoquímica? Por supuesto, el metil carbono electrófilo en estas reacciones es aquiral, por lo que la inversión no es aparente. Para demostrar inversión, se ha llevado a cabo el siguiente experimento con catecol-O-metiltransferasa:
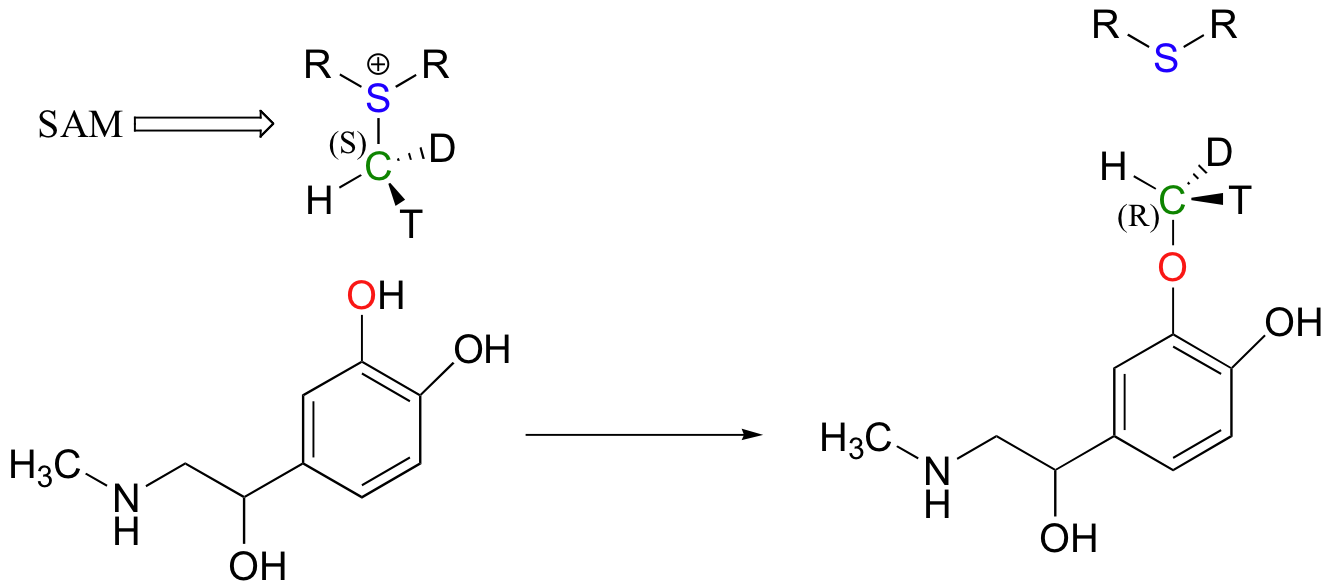
Aquí, el grupo metilo de SAM se hizo quiral incorporando isótopos de hidrógeno tritio (3 H, T) y deuterio (2 H, D). Los investigadores determinaron que la reacción ocurrió con inversión de configuración, como se esperaba para un desplazamiento S N 2 (J. Biol. Chem. 1980, 255, 9124).
| Ejemplo |
Colaboradores
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

