8.1: Estructura de alqueno
- Page ID
- 76982
Objetivo de aprendizaje
- describir la estructura electrónica de los alquenos usando la Teoría de Orbitales Moleculares (MO) y la
Los alquenos son una clase de hidrocarburos (es decir, que contienen solo carbono e hidrógeno). Son compuestos insaturados con al menos un doble enlace carbono-carbono. El doble enlace hace que los alquenos sean más reactivos que los alcanos. Olefina es otro término usado para describir alquenos. El grupo alqueno también se puede llamar un grupo vinilo y los carbonos que comparten el doble enlace se pueden llamar carbonos vinílicos.
Alquenos
La nomenclatura de los alquenos está cubierta en el capítulo 3. Las fórmulas estructurales condensadas para los primeros ocho alquenos se listan en la Tabla\(\PageIndex{1}\) junto con algunas propuestas físicas relevantes. Así, CH 2 =CH 2 significa
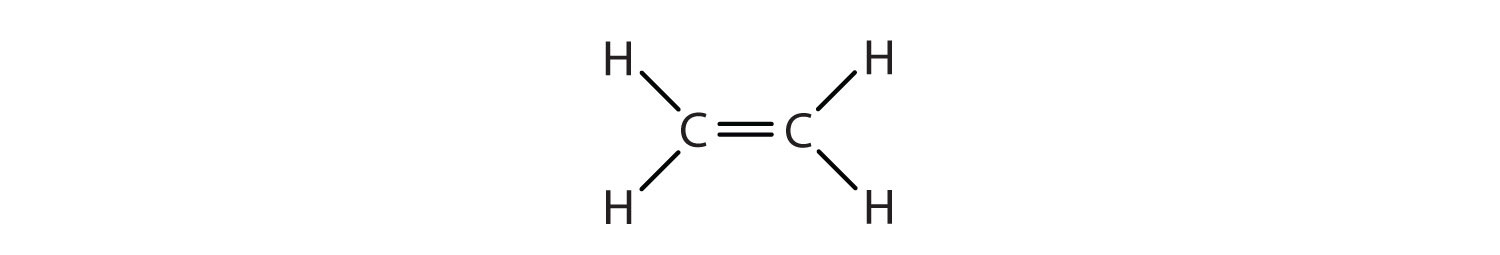
El doble enlace es compartido por los dos átomos de carbono y no involucra a los átomos de hidrógeno, aunque la fórmula condensada no hace evidente este punto. Obsérvese que la fórmula molecular para el eteno es C 2 H 4, mientras que para etano es C 2 H 6.
Estructura de Eteno - el alqueno más simple
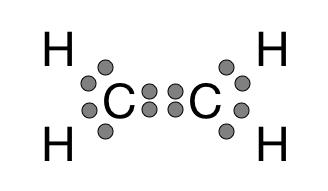
El eteno no es una molécula muy complicada. Se compone de cuatro 1s 1 átomos de hidrógeno y dos 2s 2 2\(p_x\) 1 2 2 2\(p_y\) 2 átomos de carbono. Estos átomos de carbono ya tienen cuatro electrones, pero cada uno quiere obtener cuatro más para que tengan un ocho completo en el caparazón de valencia. Tener ocho electrones de valencia alrededor del carbono le da al átomo mismo la misma configuración electrónica que el neón, un gas noble. El carbono quiere tener la misma configuración que Neon porque cuando tiene ocho electrones de valencia el carbono está en su estado más estable, de menor energía, tiene todos los electrones que quiere, por lo que ya no es reactivo.
Esto forma un total de tres enlaces a cada átomo de carbono, dándoles una\(sp^2\) hibridación. Dado que el átomo de carbono está formando tres enlaces sigma en lugar de los cuatro que puede, solo necesita hibridar tres de sus orbitales externos, en lugar de cuatro. Esto lo hace usando el\(2s\) electrón y dos de los\(2p\) electrones, dejando al otro sin cambios. A este nuevo orbital se le llama\(sp^2\) híbrido porque eso es exactamente lo que es, está hecho de orbitales uno s orbitales y dos p orbitales.
.png)
Cuando los átomos son\(sp^2\) híbridos tienen una estructura plana trigonal. Estas estructuras son muy similares a un signo de 'paz', hay un átomo central con tres átomos a su alrededor, todo en un plano. Las moléculas planas trigonales tienen un ángulo de unión ideal de 120° en cada lado.
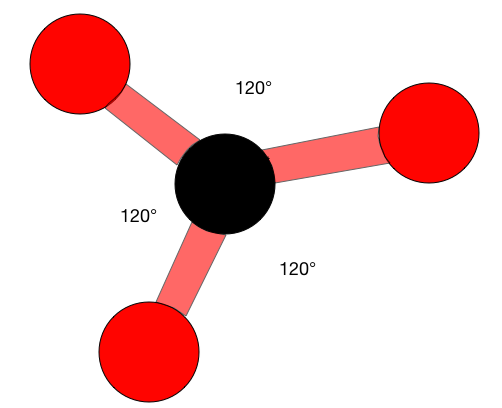
El ángulo de enlace H-C-H es de 117°, que está muy cerca de los 120° ideales de un carbono con\(sp^2\) hibridación. Los otros dos ángulos (H-C=C) son ambos 121.5°.
Rigidez en Eteno
Existe rigidez en la molécula de eteno debido a los carbonos de doble enlace. Un doble enlace consiste en un enlace sigma formado por superposición de orbitales híbridos sp 2 y un enlace pi formado por superposición de orbitales paralelos de 2 p. En el eteno no hay rotación libre sobre el enlace sigma carbono-carbono porque estos dos carbonos también comparten un\(\pi\) enlace. Un\(\pi\) enlace solo se forma cuando existe un solapamiento adecuado entre ambos orbitales p superior e inferior. La rotación libre de los orbitales p hace que estén a 90° entre sí rompiendo el\(\pi\) enlace porque no habría superposición. Dado que el\(\pi\) enlace es esencial para la estructura del eteno no debe romperse, por lo que no puede haber rotación libre alrededor del enlace sigma carbono-carbono. Los dos átomos de carbono de un doble enlace y los cuatro átomos unidos a ellos se encuentran en un plano, con ángulos de enlace de aproximadamente 120° como se muestra en la siguiente figura
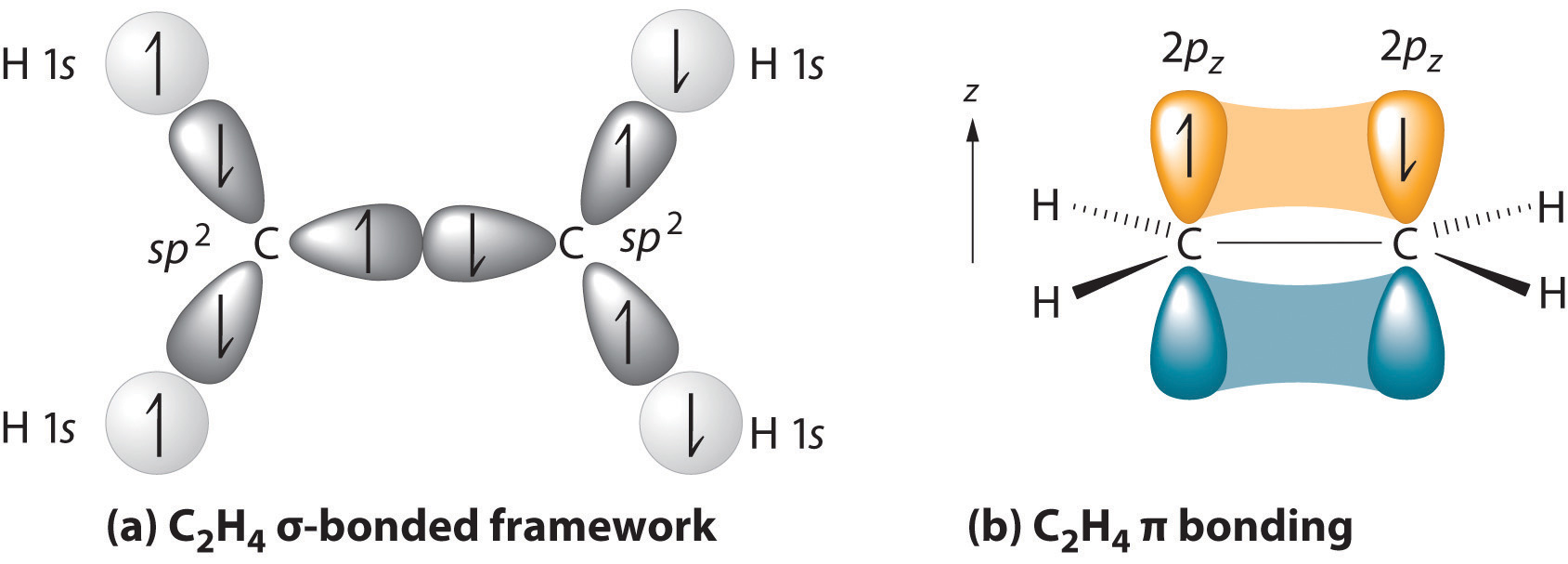
(a) La estructura unida a σestá formada por la superposición de dos conjuntos de orbitales híbridos de carbono sp 2 ocupados individualmente y cuatro orbitales de hidrógeno 1 s ocupados individualmente para formar enlaces de pares de electrones. Esto utiliza 10 de los 12 electrones de valencia para formar un total de cinco enlaces σ (cuatro enlaces C—H y un enlace C—C).
(b) Un orbital 2 p z no hibridado ocupado individualmente permanece en cada átomo de carbono para formar un enlace π carbono-carbono . (Nota: por convención, en las moléculas planas el eje perpendicular al plano molecular es el eje z.)
Los dos primeros alquenos en la Tabla\(\PageIndex{1}\), ethene and propene, are most often called by their common names—ethylene and propylene, respectively (Figure \(\PageIndex{1}\)). Ethylene is a major commercial chemical. The US chemical industry produces about 25 billion kilograms of ethylene annually, more than any other synthetic organic chemical. More than half of this ethylene goes into the manufacture of polyethylene, one of the most familiar plastics. Propylene is also an important industrial chemical. It is converted to plastics, isopropyl alcohol, and a variety of other products.
Exercise
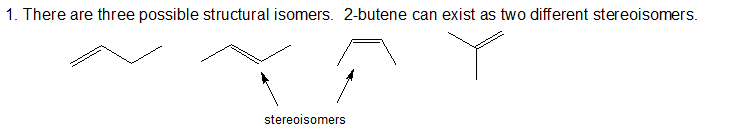
1. Although there is only one alkene with the formula C2H4 (ethene) and only one with the formula C3H6 (propene), there are several alkenes with the formula C4H8. Draw all of the possible bond line structures for alkenes with the formula C4H8 including all possible structural and stereoisomers.
- Answer
-