9.4: Hidratación - Adición de Agua Catalizada por Ácido
- Page ID
- 76020
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivo de aprendizaje
- aplicar los principios de regioselectividad y estereoselectividad a las reacciones de adición de alquenos
- predecir los productos, especificar los reactivos y discernir la reacción más eficiente para la hidratación de alquenos (hidratación catalizada por ácido; u oximercuración/desmercuración; o hidroboración/oxidación)
¿Qué es la hidratación electrofílica?
La hidratación electrofílica es la adición de hidrógeno y un grupo hidroxilo a través de los dos carbonos de un doble enlace. La hidratación electrofílica es la inversa de la deshidratación de alcoholes y así comienza la naturaleza circular de la química orgánica. Los alcoholes pueden deshidratarse para formar alquenos y los alquenos pueden sufrir reacciones de adición electrófila para formar alcoholes. El hidrógeno electrófilo es esencialmente un protón: un átomo de hidrógeno despojado de sus electrones. El hidrógeno electrófilo se usa comúnmente para ayudar a romper dobles enlaces o restaurar catalizadores.
La hidratación electrofílica de alquenos tiene aplicaciones prácticas en la fabricación de alcoholes para combustibles y reactivos para otras reacciones. La reacción básica bajo ciertas temperaturas (dadas a continuación) es la siguiente:
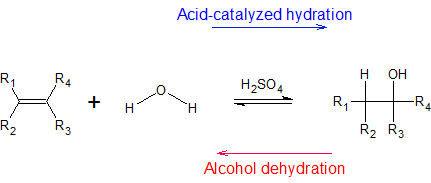
En secciones posteriores, aprenderemos que el sulfato de mercurio (II) y el borano también son electrófilos que pueden reaccionar con alquenos para formar productos de hidratación. Cada vía de reacción tiene sus propias consideraciones regio- y estereoquímicas. En el siguiente ejemplo, vemos que el mismo alqueno produce diferentes productos de hidratación dependiendo de la vía de hidratación.

Mecanismo para Hidratación Catalizada por Ácido de Alquenos

Temperaturas para Tipos de Síntesis de Alcohol
El calor se utiliza para catalizar la hidratación electrófila; debido a que la reacción está en equilibrio con la deshidratación de un alcohol, que requiere temperaturas más altas para formar un alqueno, se requieren temperaturas más bajas para formar un alcohol. Las temperaturas exactas utilizadas son muy variables y dependen del producto que se esté formando.
- Alcohol Primario: Menos de 170ºC
- Alcohol Secundario: Menos de 100ºC
- Alcohol Terciario: Menos de 25ºC
Pero... ¿Por qué Funciona la Hidratación Electrofílica?
- Un alqueno colocado en un ácido fuerte acuoso no nucleofílico inmediatamente “se extiende” con su doble enlace y ataca uno de los átomos de hidrógeno del ácido (mientras tanto, el enlace entre el oxígeno y el hidrógeno realiza escisión heterolítica hacia el oxígeno, es decir, ambos electrones del oxígeno/ el enlace sencillo de hidrógeno se mueve hacia el átomo de oxígeno).
- Se forma un carbocatión sobre el alqueno original (ahora alcano) en la posición más sustituida, donde el extremo de oxígeno del agua ataca con sus 4 electrones de valencia no enlazados (el oxígeno tiene 6 electrones de valencia total porque se encuentra en el Grupo 6 de la tabla periódica y la segunda fila hacia abajo: dos electrones en un 2s- orbitales y cuatro en orbitales 2p. El oxígeno dona un electrón de valencia a cada enlace que forma, dejando cuatro 4 electrones de valencia no enlazados).
- Después de que el átomo de oxígeno azul forma su tercer enlace con el carbono más sustituido, desarrolla una carga positiva (3 enlaces y 2 electrones de valencia le dan al átomo de oxígeno azul una carga formal de +1).
- El enlace entre el hidrógeno verde y el oxígeno azul experimenta escisión heterolítica, y ambos electrones del enlace se mueven hacia el oxígeno azul. El ácido fuerte ahora cargado negativamente recoge el hidrógeno electrófilo verde.
- Ahora que la reacción está completa, el ácido fuerte no nucleofílico se regenera como catalizador y se forma un alcohol en el carbono más sustituido del alcano actual. A temperaturas más bajas, se puede formar más producto alcohólico.
¿Qué es la regioquímica y cómo se aplica?
La regioquímica se ocupa de dónde se une el sustituyente en el producto. Las reglas de Zaitsev y Markovnikov abordan la regioquímica, pero la regla de Zaitsev se aplica al sintetizar un alqueno mientras que la regla de Markovnikov describe dónde se une el sustituyente al producto. En el caso de la hidratación electrofílica, la regla de Markovnikov es la única regla que se aplica directamente. Vea lo siguiente para una explicación en profundidad de la regioquímica Explicación de Markovnikov: Adiciones radicales - Formación de productos anti-Markovnikov
En el mecanismo para un alcohol de 3º mostrado anteriormente, el H rojo se agrega al carbono menos sustituido conectado a los dobles enlaces nucleofílicos (tiene menos carbonos unidos a él). Esto significa que el carbocatión se forma en el carbono 3º, lo que hace que sea altamente estabilizado por hiperconjugación: los electrones en enlaces sigma (simples) cercanos ayudan a llenar el orbital p vacío del carbocatión, lo que disminuye la carga positiva. Más sustitución en un carbono significa que hay más enlaces sigma disponibles para “ayudar” (usando superposición) con la carga positiva, lo que crea una mayor estabilidad de carbocationes. En otras palabras, los carbocationes se forman en el carbono más sustituido conectado al doble enlace. Los carbocationes también se estabilizan por resonancia, pero la resonancia no es un factor importante en este caso porque se utilizan dobles enlaces carbono-carbono para iniciar la reacción, y otras moléculas de doble enlace pueden causar una reacción completamente diferente. Si el carbocatión se forma originalmente en la parte menos sustituida del alqueno, se producen reordenamientos de carbocationes para formar más productos sustituidos.
Reordenamientos de Carbocationes - una revisión
- Desplazamientos de hidruro: un átomo de hidrógeno unido a un átomo de carbono junto al carbocatión deja que ese carbono se una con el carbocatión (después de que el hidrógeno haya tomado ambos electrones del enlace sencillo, se le conoce como hidruro). Esto cambia el carbono que alguna vez estuvo vecino a un carbocatión, y el primer carbocatión se convierte en un átomo de carbono vecino.
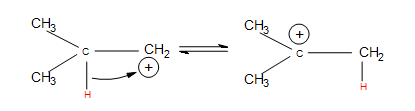
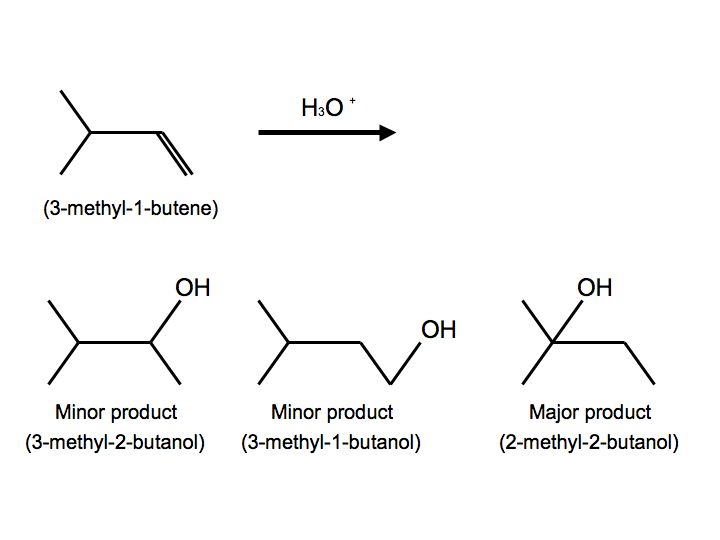
En un caso más complejo, cuando los alquenos se someten a hidratación, también observamos desplazamiento de hidruro. A continuación se muestra la reacción de 3-metil-1-buteno con H 3 O + que proporciona para preparar 2-metil-2-butanol:
.jpg)
Una vez más, vemos múltiples productos. En este caso, sin embargo, vemos dos productos menores y un producto importante. Observamos el producto principal porque el sustituyente -OH está unido al carbono más sustituido. Cuando el reactivo se somete a hidratación, el protón se adhiere al carbono #2. Por lo tanto, el carbocatión está en el carbono #2. El desplazamiento del hidruro ahora ocurre cuando el hidrógeno en el carbono adyacente cambia formalmente de lugar con el carbocatión. El carbocatión ahora está listo para ser atacado por H 2 O para proporcionar un ion alquiloxonio debido a su estabilidad e hiperconjugación. La etapa final puede ser observada por otra molécula de agua que ataca el protón en el ion alquiloxonio para proporcionar un alcohol. A continuación vemos este mecanismo:
.jpg)
- Desplazamientos de alquilo: si no hay átomos de hidrógeno disponibles para un desplazamiento de hidruro, todo un grupo metilo realiza el mismo desplazamiento.

El nucleófilo ataca la carga positiva formada sobre el carbono más sustituido conectado al doble enlace, porque el nucleófilo está buscando esa carga positiva. En el mecanismo para un alcohol de 3º mostrado arriba, el agua es el nucleófilo. Cuando se retira la H verde de la molécula de agua, el alcohol se une al carbono más sustituido. De ahí que la hidratación electrofílica siga la regla de Markovnikov.
Estereoquímica de la hidratación catalizada por ácidos
La estereoquímica trata de cómo los sustituyentes se unen en el producto direccionalmente. Los guiones y las cuñas denotan la estereoquímica al mostrar si la molécula o el átomo entra o sale del plano del tablero. Siempre que el enlace sea una simple línea recta simple, la molécula que está unida es igualmente probable que se encuentre entrando en el plano de la placa ya que está fuera del plano de la placa. Esto indica que el producto es una mezcla racémica.
No hay control estereoquímico en las reacciones de hidratación catalizadas por ácido. El carbocatión intermedio tiene la geometría plana trigonal de hibridación sp 2 lo que permite la reacción posterior con agua de cualquier orientación.

La hidratación electrófila adopta una estereoquímica en la que es igualmente probable que el sustituyente se una apuntando hacia el plano de la placa ya que apunta hacia fuera del plano de la placa. El producto alcohólico de 3º podría parecerse a cualquiera de los siguientes productos:
Nota: Siempre que se use una línea recta junto con guiones y cuñas en la misma molécula, podría estar denotando que el enlace de línea recta está en el mismo plano que el tablero. Practicar con un kit de modelo molecular e intentar los problemas de práctica al final puede ayudar a eliminar cualquier ambigüedad.
¿Es esto una Síntesis Reversible?
La hidratación electrofílica es reversible porque un alqueno en el agua está en equilibrio con el producto alcohólico. Para oscilar el equilibrio de una forma u otra, se puede cambiar la temperatura o la concentración del ácido fuerte no nucleofílico. Por ejemplo:
- Menos ácido sulfúrico o fosfórico y un exceso de agua ayudan a sintetizar más producto alcohólico.
- Las temperaturas más bajas ayudan a sintetizar más producto alcohólico.
¿Hay una mejor manera de agregar agua para sintetizar un alcohol a partir de un alqueno?
Existe una vía más eficiente: ver Oximercuración - Demercuración: Una Adición Electrofílica Especial. La oximercuración no permite reordenamientos, pero sí requiere el uso de mercurio, que es altamente tóxico. Las detracciones para usar hidratación electrófila para hacer alcoholes incluyen:
- Permitir reordenamientos de carbocationes
- Pocos rendimientos debido a que los reactivos y productos están en equilibrio
- Permitir mezclas de productos (tales como un enantiómero (R) y un enantiómero (S))
- Uso de ácido sulfúrico o fosfórico
Ejercicio
1. Dibuje la estructura de la línea de unión para el producto principal de cada reacción.

- Contestar
-
1.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Lance Peery (UCD), Duyen Dao-Tran (UCD)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
Jim Clark (Chemguide.co.uk)
Prof. Steven Farmer (Sonoma State University)


