9.12: Oxidación de Alquenos - Epoxidación
- Page ID
- 75998
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivo de aprendizaje
- reconocer reacciones orgánicas de oxidación y reducción
- predecir los productos/especificar los reactivos para la epoxidación de alquenos
Oxidación - una mirada más cercana
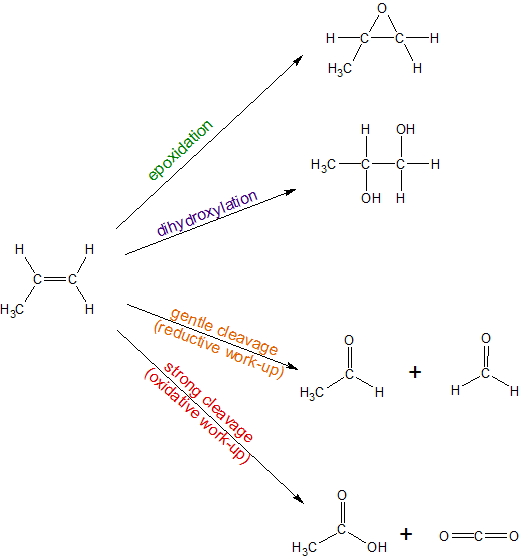
Hay una variedad de reactivos oxidativos que pueden reaccionar con alquenos. Estos reactivos oxidan el alqueno en diferentes grados y tienen diferentes aplicaciones sintéticas. Puede ser útil describir la fuerza oxidativa relativa de los reactivos. Algunos reactivos son tan fuertes que la cadena de carbono se escindirá en el alqueno. Esta reactividad también puede ser una distinción útil. Antes de explorar los detalles específicos de estas diferentes vías de reacción, veamos los patrones generales de reactividad de grupos funcionales.
Los son cuatro niveles de oxidación para alquenos. El más suave y menos oxidativo es la formación de epóxido (oxaciclopropano) en la que los carbonos vinílicos comparten un solo átomo de oxígeno como un anillo de tres miembros. La oxidación moderada convertirá el alqueno en un diol vecinal en el que cada carbono vinílico está unido a un átomo de oxígeno independiente. Las reacciones oxidativas más fuertes escinden la cadena carbonada en el alqueno. Si bien el proceso químico general es una reacción de oxidación, el tratamiento (segundo paso) de la reacción se puede realizar en condiciones reductivas o suaves o una reacción de escisión oxidativa fuerte puede ocurrir con los reactivos más fuertes. Estas cuatro vías de reacción se resumen a continuación.
Síntesis de epóxido (oxaciclopropano) por ácido peroxicarboxílico
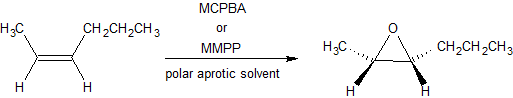
Los anillos de oxaciclopropano, también llamados anillos epóxido, son reactivos útiles que pueden abrirse mediante una reacción adicional para formar dioles anti vecinales. Una forma de sintetizar anillos de oxaciclopropano es a través de la reacción de un alqueno con un ácido peroxicarboxílico, como MCPBA (ácido m-cloroperoxibenzoico). La síntesis de oxaciclopropano por ácido peroxicarboxílico requiere un alqueno y un ácido peroxicarboxílico así como un disolvente apropiado. El ácido peroxicarboxílico tiene la propiedad única de tener un átomo de oxígeno electropositivo en el grupo COOH. La reacción se inicia por el átomo de oxígeno electrófilo que reacciona con el doble enlace nucleófilo carbono-carbono. El mecanismo implica una reacción concertada con un estado de transición circular de cuatro partes. El resultado es que el átomo de oxígeno originalmente electropositivo termina en el anillo de oxaciclopropano y el grupo COOH se convierte en COH.
Mecanismo
El mecanismo es una reacción concertada entre el alqueno y el peroxiácido. Como se ve con otras reacciones concertadas, es estereoespecífico: un cis-alqueno producirá un cis-epóxido y un alqueno trans producirá un trans-epóxido.
.png)
Los ácidos peroxicarboxílicos son generalmente inestables. Una excepción es MCPBA, que se muestra en el mecanismo anterior. A menudo abreviado MCPBA, es un sólido cristalino estable. En consecuencia, MCPBA es popular para uso en laboratorio. Sin embargo, MCPBA puede ser explosivo bajo algunas condiciones. Los ácidos peroxicarboxílicos a veces son reemplazados en aplicaciones industriales por ácido monoperftálico, o el ion monoperoxiftalato unido al magnesio, que da monoperoxiftalato de magnesio (MMPP). En cualquier caso, se usa un disolvente no acuoso tal como cloroformo, éter, acetona o dioxano. Esto se debe a que en un medio acuoso con cualquier catalizador ácido o base presente, el anillo epóxido se hidroliza para formar un diol vecinal, una molécula con dos grupos OH en los carbonos vecinos. (Para mayor explicación de cómo esta reacción conduce a dioles vecinales, ver más abajo.) Sin embargo, en un disolvente no acuoso, se evita la hidrólisis y el anillo epóxido puede aislarse como producto. Los rendimientos de reacción de esta reacción son usualmente de aproximadamente 75%. La velocidad de reacción se ve afectada por la naturaleza del alqueno, con más enlaces dobles nucleofílicos dando como resultado reacciones más rápidas.
Ejemplo\(\PageIndex{1}\)
.png)
Dado que la transferencia de oxígeno es al mismo lado del doble enlace, el anillo de oxaciclopropano resultante tendrá la misma estereoquímica que el alqueno de partida. Una buena manera de pensar en esto es que se rote el alqueno para que algunos constituyentes salgan adelante y algunos se queden atrás. Después, el oxígeno se inserta en la parte superior. (Ver el producto de la reacción anterior.) Una forma en que el anillo epóxido se puede abrir es mediante una oxidación-hidrólisis catalizada por ácido. La oxidación-hidrólisis da un diol vecinal, una molécula con grupos OH en los carbonos vecinos. Para esta reacción, la dihidroxilación es anti ya que, debido al impedimento estérico, el anillo es atacado desde el lado opuesto al átomo de oxígeno existente. Así, si el alqueno de partida es trans, el diol vecinal resultante tendrá un estereocentro S y un estereocentro R. Pero, si el alqueno de partida es cis, el diol vecinal resultante tendrá una mezcla racémica de enantiómeros S, S y R, R.
Ejercicio\(\PageIndex{1}\)
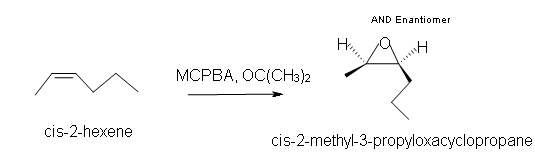
1. Predecir el producto de la reacción de cis-2-hexeno con MCPBA (ácido meta-cloroperoxibenzoico)
a) en acetona solvente.
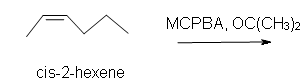
b) en un medio acuoso con catalizador ácido o base presente.
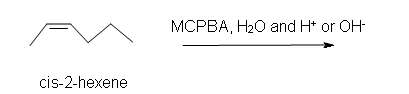
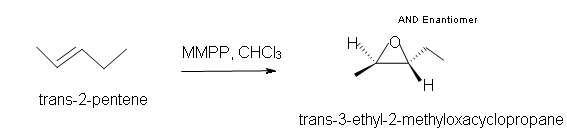
2. Predecir el producto de la reacción de trans-2-penteno con monoperoxiftalato de magnesio (MMPP) en un solvente de cloroformo.
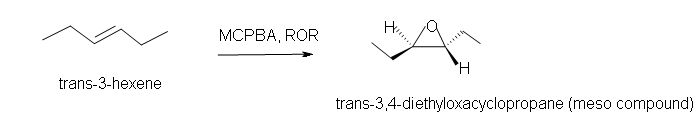
3. Predecir el producto de la reacción de trans-3-hexeno con MCPBA en disolvente éter.

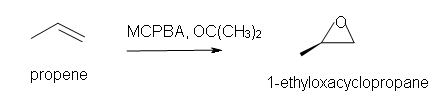
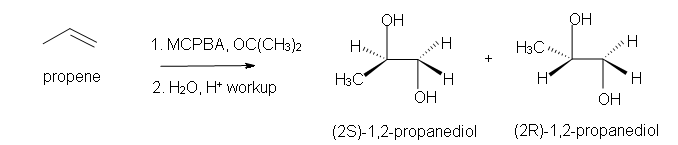
4. Predecir la reacción del propeno con MCPBA.
a) en acetona solvente
b) después del tratamiento acuoso.
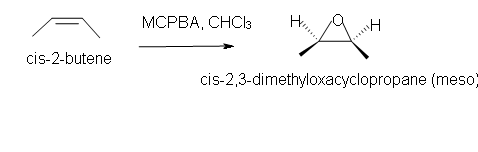
5. Predecir la reacción de cis-2-buteno en cloroformo solvente.
.png)
- Contestar
-
1. a) cis-2-metil-3-propiloxaciclopropano
b) (2R,3R) -2,3-hexanodiol racémico y (2S,3S) -2,3-hexanodiol
2. Trans-3-etil-2-metiloxaciclopropano.
3. Trans-3,4-dietiloxaciclopropano.
4. a) 1-etil-oxaciclopropano
b) (2S) -1,2-propanodiol racémico y (2R) -1,2-propanodiol
5. cis-2,3-dimetiloxaciclopropano
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
- Shivam Nand
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
- Kristen Perano


