9.13: Dihidroxilación de Alquenos
- Page ID
- 76018
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivo de aprendizaje
- predecir los productos/especificar los reactivos para la dihidroxilación de alquenos
Dihidroxilación de alquenos
Los alquenos pueden ser dihidroxilados por dos vías estereoquímicas diferentes: anti-dihidroxilación o sindihidroxilación. La apertura de epóxidos sigue el mecanismo antidihidroxilación, mientras que el permanganato de potasio o el tetróxido de osmio producen los productos sin-dihidroxilados. La reacción del tertróxido de osmio también puede realizarse mediante un proceso de dos etapas: 1) OsO 4 en piridina seguido de 2) H 2 S o NaHSO 3. Es importante señalar que diferentes profesores enfatizarán diferentes sistemas de reactivos para lograr la misma reacción química. En estas situaciones, puede ser útil reconocer el papel de cada reactivo para discernir patrones.
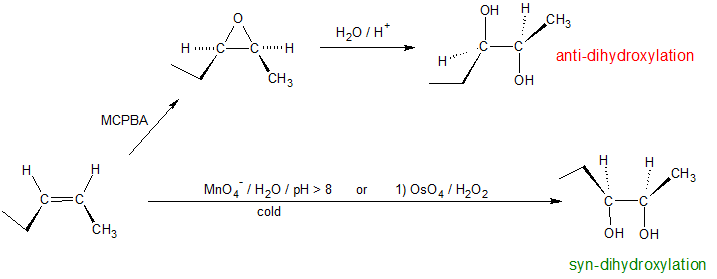
Anti dihidroxilación
Los epóxidos pueden ser escindidos por ácido acuoso para dar glicoles que a menudo son diastereoméricos con los preparados por la reacción de sin-hidroxilación descrita anteriormente. La transferencia de protones desde el catalizador ácido genera el ácido conjugado del epóxido, el cual es atacado por nucleófilos como el agua de la misma manera que el ion bromonio cíclico descrito anteriormente experimenta reacción. El resultado es la anti-hidroxilación del doble enlace, en contraste con la sin-estereoselectividad del método anterior. En la siguiente ecuación se ilustra este procedimiento para un epóxido cis-disustituido, que, por supuesto, podría prepararse a partir del cis-alqueno correspondiente. Esta hidratación de un epóxido no cambia el estado de oxidación de ningún átomo o grupo. El mecanismo para la apertura del anillo de epóxidos depende de las condiciones de reacción y se discute con más detalle en la siguiente sección de este capítulo.
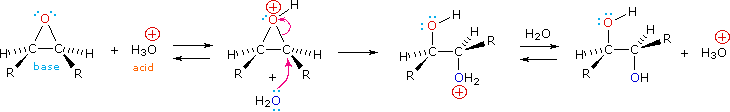
Syn Dihidroxilación
El tetróxido de osmio oxida los alquenos para dar glicoles a través de la adición de syn. Un glicol, también conocido como diol vecinal, es un compuesto con dos grupos -OH en carbonos adyacentes.

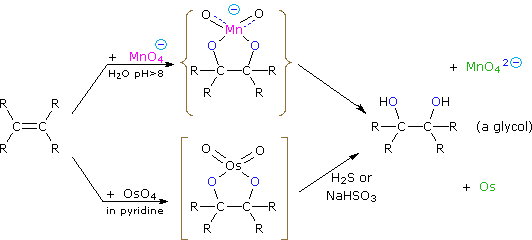
Los productos dihidroxilados (glicoles) se obtienen por reacción con permanganato potásico acuoso (pH > 8) o tetróxido de osmio en solución de piridina. Ambas reacciones parecen proceder por el mismo mecanismo (mostrado a continuación); el intermedio metalocíclico puede aislarse en la reacción de osmio. En solución básica el anión permanganato púrpura se reduce al ion manganato verde, proporcionando una buena prueba de color para el grupo funcional de doble enlace. Del mecanismo que se muestra aquí esperaríamos sin-estereoselectividad en la unión al oxígeno, y la regioselectividad no es un problema.
Cuando se ve en contexto con las reacciones de adición discutidas anteriormente, la reacción de hidroxilación puede parecer inverosímil. El permanganato y el tetróxido de osmio tienen configuraciones similares, en las que el átomo metálico ocupa el centro de una agrupación tetraédrica de átomos de oxígeno cargados negativamente. ¿Cómo, entonces, interactuaría tal especie con los electrones pi-nucleofílicos de un doble enlace? Una posible explicación es que un d-orbital vacío del átomo metálico electrófilo se extiende mucho más allá de los átomos de oxígeno circundantes e inicia la transferencia de electrones desde el doble enlace al metal, de la misma manera señalada anteriormente para el platino. La unión posterior de los oxígenos nucleofílicos al orbital π*-orbital antienlace completa esta interacción. El resultado es la formación de un intermedio metalocíclico, como se muestra arriba.
La reacción con\(OsO_4\) es un proceso concertado que tiene un intermedio cíclico y sin reordenamientos. La dihidroxilación de sinas vecinales complementa la secuencia epóxido-hidrólisis que constituye una anti dihidroxilación de un alqueno. Cuando un alqueno reacciona con tetróxido de osmio, se pueden formar estereocentros en el producto de glicol. Los alquenos cis dan productos meso y los alquenos trans dan mezclas racémicas.

\(OsO_4\)se forma lentamente cuando el polvo de osmio reacciona con gases\(O_2\) a temperatura ambiente. La reacción del sólido a granel requiere calentamiento a 400 °C:
\[Os_{(s)} + 2O_{2\;(g)} \rightarrow OS_4\]
Dado que el tetróxido de osmio es caro y altamente tóxico, la reacción con alquenos se ha modificado. Las cantidades catalíticas de OsO 4 y las cantidades estequiométricas de un agente oxidante como el peróxido de hidrógeno se utilizan ahora para eliminar algunos peligros. También, un reactivo más antiguo que se utilizó en lugar de OsO 4 fue permanganato de potasio,\(KMnO_4\). Aunque los syn dioles resultarán de la reacción de KMnO 4 y un alqueno, el permanganato de potasio es menos útil ya que da rendimientos pobres del producto debido a la sobreoxidación.
Destacado Químico
Los fármacos antitumorales se han formado mediante el uso de dihidroxilación. Este método se ha aplicado a la síntesis enantioselectiva de ovalicina, que es una clase de productos derivados de hongos llamados agentes antiangiogénicos. Estos productos antitumorales pueden cortar el suministro de sangre a los tumores sólidos. Un derivado de la ovalicina, TNP-470, es químicamente estable, no tóxico y no inflamatorio. TNP-470 se ha utilizado en investigaciones para determinar su efectividad en el tratamiento del cáncer de mama, cerebro, cuello uterino, hígado y próstata.
Ejercicio
1. Dar el producto principal.
.bmp)
2. ¿Cuál es el producto en la dihidroxilación de (Z) -3-hexeno?

3. ¿Cuál es el producto en la dihidroxilación de (E) -3-hexeno?

4. Dibuja el intermedio de esta reacción.
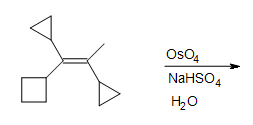
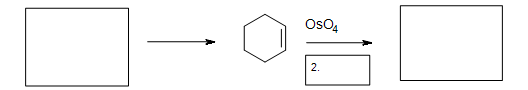
5. Rellene los reactivos, reactivos y producto faltantes.
- Responder
-
1. Se forma un syn-1,2-etanodiol. No hay estereocentro en esta reacción en particular. Los grupos OH están del mismo lado.

2. Se forma meso-3,4-hexanodiol. Hay 2 estereocentros en esta reacción.
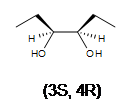
3. Se forma una mezcla racémica de 3,4-hexanodiol. Hay 2 estereocentros en ambos productos.

4. Se forma un éster ósmico cíclico.

5. La reacción de cicloadición de Diels-Alder es necesaria en la primera caja para formar el ciclohexeno. La segunda caja necesita un reactivo para reducir el éster cíclico intermedio (no mostrado). La tercera caja tiene el producto: 1,2-ciclohexanodiol.

Referencias
- Dehestani, Ahmad et al. (2005). Reducción asistida por ligando de tetróxido de osmio con hidrógeno molecular mediante un mecanismo [3+2]. Revista de la Sociedad Americana de Química, 2005, 127 (10), 3423-3432.
- Sorrell, Thomas, N. Química Orgánica. Nueva York: Libros de Ciencias Universitarias, 2006.
- Vollhardt, Peter y Neil E. Schore. Química Orgánica: Estructura y Función. 5ta Edición. Nueva York: W. H. Freeman & Company, 2007.
Colaboradores y Atribuciones
- Shivam

