9.14: Apertura de Epóxidos - Condiciones Ácidas versus Básicas
- Page ID
- 75958
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivo de aprendizaje
- predecir los productos/especificar los reactivos para la dihidroxilación de alquenos
Reacciones de apertura de anillo epóxido - S N 1 vs S N 2, regioselectividad y estereoselectividad
Las reacciones no enzimáticas de apertura de anillo de epóxidos proporcionan una opacidad para revisar los mecansims de sustitución nucelofílica. Las reacciones de apertura del anillo pueden proceder por mecanismos S N 2 o S N 1, dependiendo de la naturaleza del epóxido y de las condiciones de reacción. Si el epóxido es asimétrico, la estructura del producto variará según qué mecanismo domine. Cuando un epóxido asimétrico se somete a solvolisis en metanol básico, la apertura del anillo ocurre por un mecanismo S N 2, y el carbono menos sustituido reacciona con el nucleófilo bajo consideraciones estéricas y produce el producto B en el ejemplo siguiente.

Por el contrario, cuando ocurre la solvolisis en metanol ácido, la reacción se produce por un mecanismo con carácter S N 1 sustancial, y el carbono más sustituido reacciona con el nucleófilo bajo consideraciones electrostáticas y produce el producto A en el siguiente ejemplo.

Ambos son buenos ejemplos de reacciones regioselectivas. En una reacción regioselectiva, dos (o más) isómeros constitucionales diferentes son posibles como productos, pero uno se forma preferentemente (o a veces exclusivamente).
Examinemos primero el caso básico, S N 2. El grupo lápida es un anión alcóxido, ya que no hay ácido disponible para protonar el oxígeno antes de la apertura del anillo. Un alcóxido es un grupo de salida pobre y, por lo tanto, es poco probable que el anillo se abra sin un 'empuje' del nucleófilo.

El nucleófilo en sí es potente: un ion metóxido desprotonado y cargado negativamente. Cuando una reacción de sustitución nucleofílica involucra un grupo saliente pobre y un potente nucleófilo, es muy probable que proceda por un mecanismo S N 2.
¿Qué pasa con el electrófilo? Hay dos carbonos electrofílicos en el epóxido, pero el mejor objetivo para el nucleófilo en una reacción de S N 2 es el carbono que está menos obstaculizado. Esto explica el resultado regioquímico observado. Al igual que en otras reacciones de S N 2, las reacciones nucleofílicas tienen lugar con orientación posterior relativa al grupo de salida, resultando en inversión en el carbono electrófilo.
Probablemente la mejor manera de representar la reacción de apertura de anillo de epóxido catalizada por ácido es como un híbrido, o cruce, entre un mecanismo S N 2 y S N 1. Primero, el oxígeno es protonado, creando un buen grupo de salida (paso 1 a continuación). Las consideraciones electrostáticas tienen mayor importancia con un intermedio protonado. A medida que el enlace carbono-oxígeno comienza a romperse (paso 2), la carga positiva se construye sobre el carbono más sustituido con mayor estabilidad de carbocationes.

A diferencia de una reacción de S N 1, el nucleófilo reacciona con el carbono electrófilo (etapa 3) antes de que se forme un intermedio de carbocatión completo.

La reacción tiene lugar preferentemente desde la parte posterior (como en una reacción de S N 2) porque el enlace carbono-oxígeno todavía está en su lugar, y el oxígeno bloquea la reacción desde el lado frontal. Observe, sin embargo, que el resultado regioquímico es diferente de la reacción catalizada por bases. En el proceso catalizado por ácido, el nucleófilo reacciona con el carbono más sustituido porque es este carbono el que tiene un mayor grado de carga positiva y los electrostáticos (estabilidad de carbocationes) toman un papel dominante en la determinación del mecanismo.
Ejemplo\(\PageIndex{1}\)
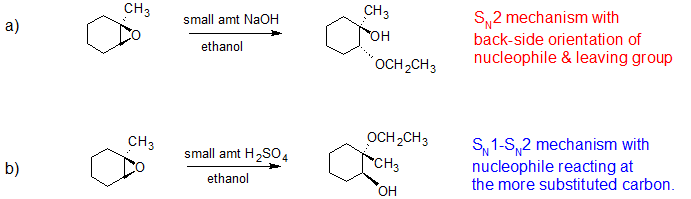
Predecir el/los producto (s) principal (s) de la reacción de apertura del anillo que ocurre cuando el epóxido que se muestra a continuación se trata con:
- etanol y una pequeña cantidad de hidróxido de sodio
- etanol y una pequeña cantidad de ácido sulfúrico
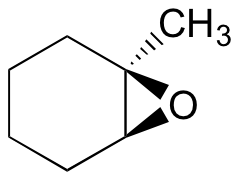
Pista: ¡asegúrate de considerar tanto la regioquímica como la estereoquímica!
Solución
Adición de HX
Los epóxidos también pueden ser abiertos por otros ácidos anhidros (HX) para formar una trans-halohidrina. Cuando ambos carbonos epóxido son primarios o secundarios, el anión halógeno atacará al carbono menos sustituido y una reacción similar a S N 2. Sin embargo, si uno de los carbonos del epóxido es terciario, el anión halógeno atacará principalmente la cápula terciaria en una reacción similar a S N 1.

Ejemplo\(\PageIndex{1}\)


Ejercicio
1. Ante lo siguiente, predecir el producto asumiendo que solo el epóxido está afectado. (Recuerda la estereoquímica)

2. Predecir el producto de lo siguiente, similar al anterior pero se usa un nucleófilo diferente y no en condiciones ácidas. (Recuerda la estereoquímica)

3. Los epóxidos son a menudo reactivos muy útiles para usar en síntesis cuando el producto deseado es un estereoisómero único. Si el siguiente alqueno reaccionara con un oxiácido para formar un epóxido, ¿el resultado sería un enantioméricamente puro? Si no, ¿cuál sería?

- Responder
-
1.
 Tenga en cuenta que la estereoquímica se ha invertido
Tenga en cuenta que la estereoquímica se ha invertido2,

3.
Primero, mira la simetría del alqueno. Hay un plano espejo, que se muestra aquí.
 Entonces, piense en el mecanismo de epoxidación con un oxiácido, tome por ejemplo m CPBA. El mecanismo está concertado, por lo que no se cambia la estereoquímica cis original. Esto lleva a “dos” epóxidos.
Entonces, piense en el mecanismo de epoxidación con un oxiácido, tome por ejemplo m CPBA. El mecanismo está concertado, por lo que no se cambia la estereoquímica cis original. Esto lleva a “dos” epóxidos. Sin embargo, estas dos imágenes especulares son realmente idénticas debido al plano especular de la geometría cis. Es un compuesto meso, por lo que el resultado final es un estereoisómero único, pero no un solo enantiómero.
Sin embargo, estas dos imágenes especulares son realmente idénticas debido al plano especular de la geometría cis. Es un compuesto meso, por lo que el resultado final es un estereoisómero único, pero no un solo enantiómero.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

