9.17: Polimerización radical de crecimiento en cadena
- Page ID
- 75972
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivo de aprendizaje
- predecir el polímero/especificar el monómero para radicales, polímeros de crecimiento de cadena de alquenos
Introducción
Todos los monómeros de los que se elaboran los polímeros de adición son alquenos o alquenos funcionalmente sustituidos. Las transformaciones químicas más comunes y favorecidas termodinámicamente de los alquenos son las reacciones de adición. Se sabe que muchas de estas reacciones de adición proceden de manera escalonada por medio de intermedios reactivos, y este es el mecanismo seguido por la mayoría de las polimerizaciones. Aquí se presenta un diagrama general que ilustra este ensamblaje de macromoléculas lineales, que soporta el nombre de polímeros de crecimiento de cadena. Dado que un enlace pi en el monómero se convierte en un enlace sigma en el polímero, la reacción de polimerización suele ser exotérmica en 8 a 20 kcal/mol. En efecto, se han reportado casos de polimerizaciones explosivamente incontroladas.

Es útil distinguir cuatro procedimientos de polimerización que se ajustan a esta descripción general.
• Polimerización por radicales El iniciador es un radical, y el sitio de propagación de reactividad (*) es un radical de carbono.
• Polimerización catiónica El iniciador es un ácido, y el sitio de propagación de reactividad (*) es un carbocatión.
• Polimerización aniónica El iniciador es un nucleófilo, y el sitio de propagación de reactividad (*) es un carbanión.
• Coordinación Polimerización Catalítica El iniciador es un complejo de metal de transición, y el sitio de propagación de reactividad (*) es un complejo catalítico terminal.
Polimerización radical de crecimiento en cadena
Prácticamente todos los monómeros descritos anteriormente están sujetos a polimerización por radicales. Dado que esto puede ser iniciado por trazas de oxígeno u otras impurezas menores, las muestras puras de estos compuestos a menudo son “estabilizadas” por pequeñas cantidades de inhibidores de radicales para evitar reacciones no deseadas. Cuando se desea la polimerización radical, se debe iniciar usando un iniciador de radicales, como un peróxido o ciertos compuestos azo. A continuación se presentan las fórmulas de algunos iniciadores comunes y las ecuaciones que muestran la formación de especies radicales a partir de estos iniciadores.
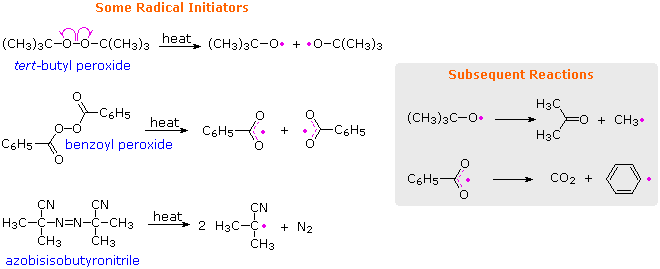
Mediante el uso de pequeñas cantidades de iniciadores, se puede polimerizar una amplia variedad de monómeros. Un ejemplo de esta polimerización radical es la conversión de estireno a poliestireno, que se muestra en el siguiente diagrama. Las dos primeras ecuaciones ilustran el proceso de iniciación, y las dos últimas ecuaciones son ejemplos de propagación en cadena. Cada unidad monomérica se suma a la cadena en crecimiento de una manera que genera el radical más estable. Dado que los radicales de carbono son estabilizados por sustituyentes de muchos tipos, la preferencia por la regioselectividad cabeza a cola en la mayoría de las polimerizaciones de adición es comprensible. Debido a que los radicales son tolerantes a muchos grupos funcionales y solventes (incluida el agua), las polimerizaciones por radicales son ampliamente utilizadas en la industria química.
En principio, una vez iniciada, podría esperarse que la polimerización por radicales continúe sin control, produciendo algunos polímeros de cadena extremadamente larga. En la práctica, se forman números mayores de cadenas de tamaño moderado, lo que indica que deben estar teniendo lugar reacciones de terminación de cadena. Los procesos de terminación más comunes son la combinación radical y la desproporción. Estas reacciones se ilustran mediante las siguientes ecuaciones. Las cadenas de polímero en crecimiento son de color azul y rojo, y el átomo de hidrógeno transferido en desproporción es de color verde. Obsérvese que en ambos tipos de terminación se eliminan dos sitios de radicales reactivos mediante conversión simultánea a producto (s) estable (s). Dado que la concentración de especies de radicales en una reacción de polimerización es pequeña en relación con otros reactivos (por ejemplo, monómeros, disolventes y cadenas terminadas), la velocidad a la que ocurren estas reacciones de terminación radical-radical es muy pequeña, y la mayoría de las cadenas en crecimiento alcanzan una longitud moderada antes de la terminación.
La importancia relativa de estas terminaciones varía con la naturaleza del monómero sometido a polimerización. Para acrilonitrilo y estireno la combinación es el proceso principal. Sin embargo, el metacrilato de metilo y el acetato de vinilo se terminan principalmente por desproporción.
Otra reacción que desvía las polimerizaciones de crecimiento radicalario de la producción de macromoléculas lineales se llama transferencia de cadena. Como su nombre lo indica, esta reacción mueve un radical de carbono de una ubicación a otra mediante una transferencia de átomo de hidrógeno intermolecular o intramolecular (de color verde). Estas posibilidades son demostradas por las siguientes ecuaciones
Las reacciones de transferencia de cadena son especialmente prevalentes en la polimerización radical de etileno a alta presión, que es el método utilizado para elaborar LDPE (polietileno de baja densidad). El radical 1º-al final de una cadena en crecimiento se convierte en un radical 2º-más estable por transferencia de átomos de hidrógeno. La polimerización adicional en el nuevo sitio radical genera un radical de cadena lateral, y esto a su vez puede conducir a la creación de otras cadenas laterales por reacciones de transferencia de cadena. Como resultado, la morfología del LDPE es una red amorfa de macromoléculas altamente ramificadas.
Ejercicio
1. Proponer las unidades monoméricas en los siguientes polímeros:

- Contestar
-
1.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

