9.18: Adiciones Biológicas de Radicales a Alquenos
- Page ID
- 75959
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivo de aprendizaje
- discutir un ejemplo de reacciones de adición biológica
Mecanismos radicales para reacciones dependientes de flavina
Las coenzimas flavinas, al igual que sus equivalentes de nicotinamida adenina dinucleótido, pueden actuar como aceptores y donantes de hidruro. En estas reacciones redox, dos electrones se transfieren juntos en forma de un ion hidruro. Sin embargo, la flavina también es capaz de mediar etapas químicas en las que se transfiere un solo electrón desapareado, es decir, la química radical. Esto se debe a la capacidad del sistema flavina para formar un radical intermedio estabilizado llamado semiquinona, formado cuando FADH 2 (o FMNH 2) dona un solo electrón, o cuando FAD (o FMN) acepta un solo electrón.

Esta capacidad de transferencia de electrones individuales de las flavinas es crítica para su papel metabólico como punto de entrada de electrones en la fase de transporte de electrones de la respiración. Los electrones 'recolectados' de la oxidación de las moléculas de combustible son canalizados, uno por uno, por FMNH 2 hacia la cadena de transporte de electrones, donde eventualmente reducen el oxígeno molecular. El NADH es incapaz de transferencia de electrones simples; todo lo que puede hacer es transferir dos electrones, en forma de hidruro, a FMN; el FMNH 2 regenerado es entonces capaz de continuar enviando electrones individuales a la cadena de transporte.

Aprenderás más detalles sobre este proceso en una clase de bioquímica.
Debido a que las flavinas son capaces de realizar química de un solo electrón y de dos electrones, los mecanismos relevantes de las reacciones catalizadas por saboenzimas suelen ser más difíciles de determinar. Recordemos la reacción de deshidrogenación catalizada por la acil-CoA deshidrogenasa (sección 16.5C) - implica la transferencia de dos electrones y dos protones (es decir, una molécula de hidrógeno) a FAD. Ambos electrones podrían transferirse juntos, con la coenzima FAD simplemente actuando como aceptor de hidruro (este es el mecanismo que consideramos anteriormente). Sin embargo, debido a que la coenzima oxidante que se usa es FAD en lugar de NAD +, también es posible que la reacción pueda proceder por un proceso intermedio radical de un solo electrón. En el mecanismo radical alterno que se propone a continuación, por ejemplo, el intermedio enolato primero dona un solo electrón al FAD, formando un intermedio radical semiquinona (paso 2). El segundo electrón se transfiere cuando el intermedio de semiquinona abstrae un hidrógeno de C b de manera homolítica (paso 3).
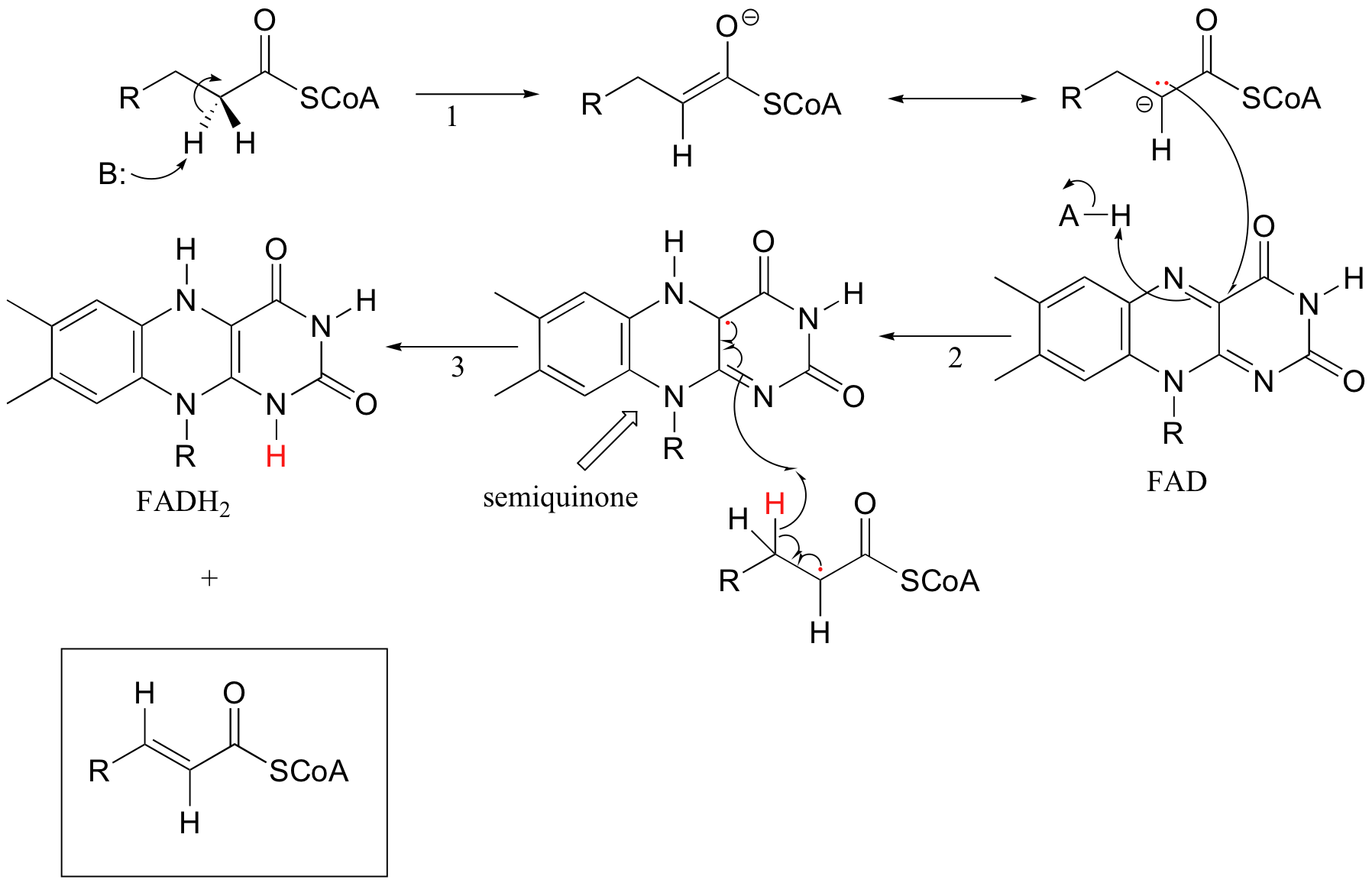
Los científicos aún no están seguros de qué mecanismo -el mecanismo de transferencia de hidruro que vimos en la sección 16.5B o la transferencia de electrones individuales detallada anteriormente- representa con mayor precisión lo que está sucediendo en esta reacción.
La eliminación conjugada catalizada por la corismato sintasa (sección 14.3B) es otro ejemplo de una reacción donde la participación de flavina arroja dudas sobre cuál es el mecanismo relevante. Esto podría ser simplemente una reacción conjugada de E1', con formación de un intermedio de carbocatión alílico. La pregunta que plaga a los investigadores que estudian esta enzima, sin embargo, es por qué se requiere FADH 2. Esta no es una reacción redox y, en consecuencia, el FADH 2 no se agota en el curso de la transformación; solo necesita estar unido en el sitio activo para que la reacción continúe. Dado que las flavinas generalmente participan en la química de un solo electrón, esto es una indicación de que los intermedios radicales pueden estar involucrados. Recientemente se ha propuesto un mecanismo alternativo, que involucra un intermedio de flavina semiquinona (J. Biol. Chem 2004, 279, 9451). Observe que un solo electrón se transfiere del sustrato a la coenzima en la etapa 2, luego se transfiere de nuevo en la etapa 4.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

