12.2: Espectros de RMN - una introducción y visión general
- Page ID
- 76671
Objetivos
Después de completar esta sección, deberías poder
- explicar, en términos generales, el origen de los efectos de blindaje en la espectroscopia de RMN.
- explicar el número de picos que ocurren en el espectro de RMN 1H o 13C de un compuesto simple, como el acetato de metilo.
- describir y esbozar un diagrama de un espectrómetro de RMN simple.
- explicar la diferencia en escalas de tiempo de RMN y espectroscopía infrarroja.
- predecir el número de picos esperados en el espectro de RMN 1H o 13C de un compuesto dado.
Notas de estudio
Antes de continuar, asegúrese de comprender que cada señal en el espectro de RMN 1H que se muestra para el acetato de metilo se debe a un ambiente de protones diferente. Los tres protones en el mismo grupo metilo son equivalentes y aparecen en el espectro como una señal. Sin embargo, los dos grupos metilo se encuentran en dos ambientes diferentes (uno es más desenfrenado) y así vemos dos señales en todo el espectro (aparte del pico de referencia de TMS).
El acetato de metilo tiene un espectro de RMN de 1H muy simple, debido a que no hay acoplamiento protón-protón, y por lo tanto no hay división de las señales. En secciones posteriores, discutimos patrones de división en espectros de RMN 1H y cómo ayudan a un químico a determinar la estructura de los compuestos orgánicos.
Los fundamentos de un experimento de RMN
Dado que los protones químicamente no equivalentes tienen diferentes frecuencias de resonancia en un mismo campo magnético aplicado, podemos ver cómo la espectroscopia de RMN puede proporcionarnos información útil sobre la estructura de una molécula orgánica. Una explicación completa de cómo funciona un instrumento de RMN moderno está más allá del alcance de este texto, pero en términos muy simples, esto es lo que sucede. Primero, se coloca un compuesto de muestra (usaremos acetato de metilo) dentro de un campo magnético aplicado muy fuerte (B 0).
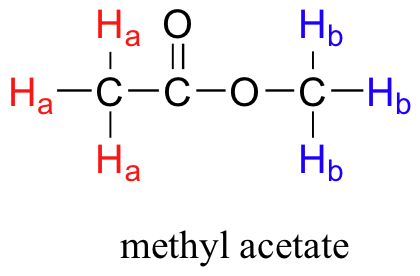
Todos los protones comienzan a preceder: los protones H a la frecuencia de precesión ω a, los protones H b en ω b. Al principio, los momentos magnéticos de (un poco más de) la mitad de los protones están alineados con B 0, y la mitad están alineados contra B 0. Entonces, la muestra es golpeada con radiación electromagnética en el rango de radiofrecuencia. Las dos frecuencias específicas que coinciden con ω a y ω b (es decir, las frecuencias de resonancia) hacen que esos protones H a y H b que están alineados con B 0 se 'volteen' así que ahora están alineados contra B 0. Al hacerlo, los protones absorben radiación en las dos frecuencias de resonancia. El instrumento de RMN registra qué frecuencias fueron absorbidas, así como la intensidad de cada absorbancia.
En la mayoría de los casos, una muestra que se analiza por RMN está en solución. Si usamos un solvente común de laboratorio (éter dietílico, acetona, diclorometano, etanol, agua, etc.) para disolver nuestra muestra de RMN, sin embargo, nos encontramos con un problema: hay muchos más protones solventes en solución que protones de muestra, por lo que las señales de los protones de la muestra se verán abrumadas. Para sortear este problema, utilizamos disolventes especiales de RMN en los que todos los protones han sido reemplazados por deuterio. Recordemos que el deuterio es NMR-activo, pero su frecuencia de resonancia es muy diferente a la de los protones, y por lo tanto es `invisible` en 1H-NMR. Algunos disolventes de RMN comunes se muestran a continuación.
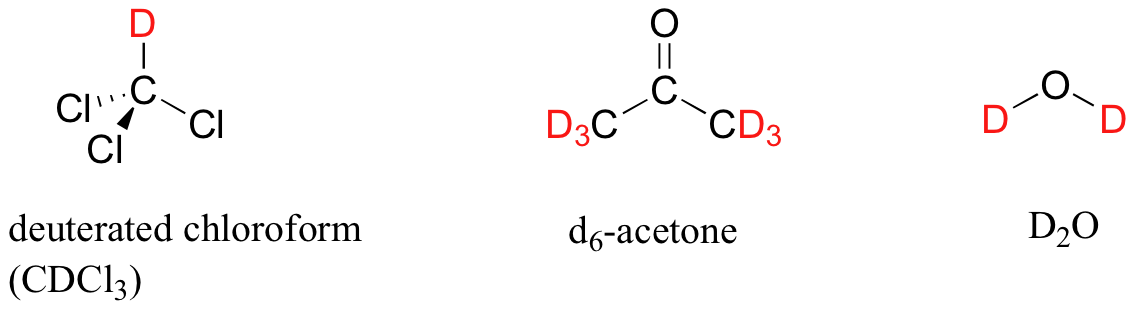
El cambio químico
Veamos una gráfica real de 1H-RMN para el acetato de metilo. Al igual que en la espectroscopia IR y UV-Vis, el eje vertical corresponde a la intensidad de absorbancia, el eje horizontal a la frecuencia (normalmente el eje vertical no se muestra en un espectro de RMN).
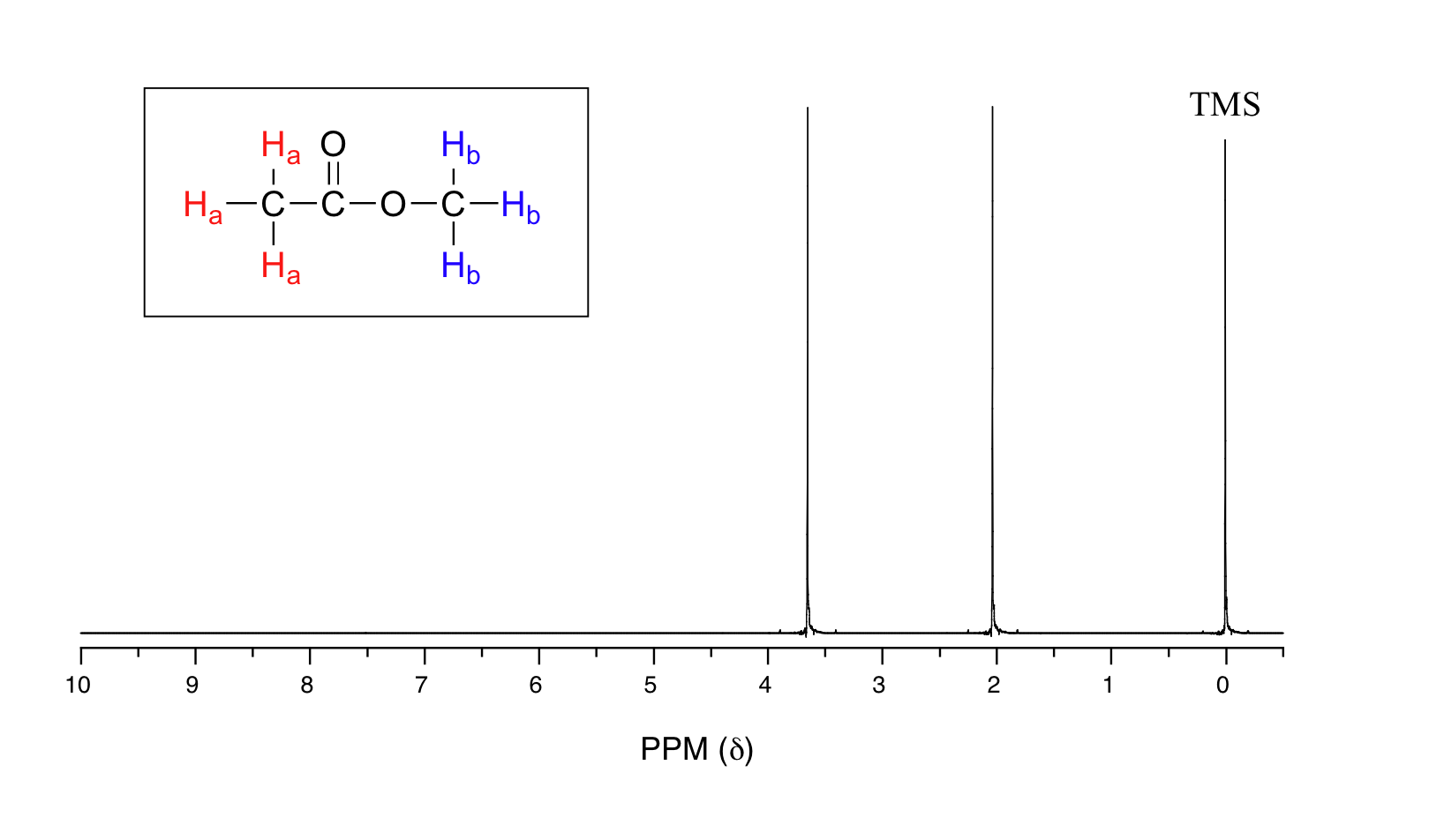
Vemos tres señales de absorbancia: dos de estas corresponden a H a y H b, mientras que el pico en el extremo derecho del espectro corresponde a los 12 protones químicamente equivalentes en tetrametilsilano (TMS), un compuesto de referencia estándar que se agregó a nuestra muestra.
Quizás se esté preguntando sobre algunas cosas en este punto: ¿por qué es necesario TMS y cuál es el significado de la etiqueta `ppm (δ) `en el eje horizontal? ¿Las unidades de frecuencia no deberían estar en Hz? Tenga en cuenta que los instrumentos de RMN de muchas intensidades de campo aplicadas diferentes se utilizan en laboratorios de química orgánica, y que el rango de frecuencia de resonancia del protón depende de la intensidad del campo aplicado. El espectro anterior se generó en un instrumento con un campo aplicado de aproximadamente 7.1 Tesla, en el que los protones de fuerza resuenan en la vecindad de 300 millones de Hz (los químicos se refieren a esto como un instrumento de 300 MHz). Si nuestro colega en otro laboratorio toma el espectro de RMN de la misma molécula usando un instrumento con un imán 2.4 Tesla, los protones resonarán a alrededor de 100 millones de Hz (así que llamaríamos a esto un instrumento de 100 MHz). Sería inconveniente y confuso tener que convertir siempre los datos de RMN de acuerdo con la intensidad de campo del instrumento utilizado. Por lo tanto, los químicos reportan las frecuencias de resonancia no como valores absolutos en Hz, sino como valores relativos a un estándar común, generalmente la señal generada por los protones en TMS. Aquí es donde entra en juego el término ppm —partes por millón—. Independientemente de la intensidad del campo magnético del instrumento que se utilice, la frecuencia de resonancia de los 12 protones equivalentes en TMS se define como un punto cero. Luego se reportan las frecuencias de resonancia de los protones en la molécula de muestra en términos de cuán superiores son, en ppm, con relación a la señal de TMS (casi todos los protones en las moléculas orgánicas tienen una frecuencia de resonancia mayor que los de TMS, por razones que exploraremos bastante pronto).
Los dos grupos protónicos en nuestra muestra de acetato de metilo se registran como resonantes a frecuencias 2.05 y 3.67 ppm superiores a TMS. Una millonésima parte (1.0 ppm) de 300 MHz es 300 Hz. Así 2.05 ppm, en este instrumento, corresponde a 615 Hz, y 3.67 ppm corresponde a 1101 Hz. Si los protones TMS observados por nuestro instrumento 7.1 Tesla resuenan exactamente a 300,000,000 Hz, esto significa que los protones en nuestras muestras de acetato de etilo están resonando a 300,000,615 y 300,001,101 Hz, respectivamente. De igual manera, si los protones TMS en el instrumento 2.4 Tesla de nuestra colega resuenan exactamente a 100 MHz, los protones de acetato de metilo en su muestra resuenan a 100,000,205 y 100,000,367 Hz (en el instrumento de 100 MHz, 1.0 ppm corresponde a 100 Hz). Los valores absolutos de frecuencia en cada caso no son muy útiles —variarán según el instrumento utilizado— pero la diferencia en la frecuencia de resonancia con respecto al estándar TMS, expresada en partes por millón, debe ser la misma independientemente del instrumento.
Expresado de esta manera, la frecuencia de resonancia para un protón dado en una molécula se llama su desplazamiento químico. Una designación simbólica de uso frecuente para el desplazamiento químico en ppm es la letra griega minúscula delta (δ). La mayoría de los protones en los compuestos orgánicos tienen valores de desplazamiento químico entre 0 y 12 ppm del TMS, aunque ocasionalmente se observan valores por debajo de cero y por encima de 12. Por convención, el lado izquierdo de un espectro de RMN (desplazamiento químico más alto) se llama campo abajo, y la dirección de la derecha se llama campo arriba.
En nuestro ejemplo de acetato de metilo incluimos con fines ilustrativos una pequeña cantidad de estándar de TMS directamente en la muestra, como era el procedimiento común para determinar el punto cero con instrumentos de RMN más antiguos. Esa práctica generalmente ya no es necesaria, ya que los instrumentos de RMN modernos están diseñados para utilizar el señal de deuterio del solvente como punto de referencia estándar, para luego extrapolar la línea base de 0 ppm que corresponde a la señal de protones TMS (en un campo aplicado de 7.1 Tesla, el átomo de deuterio en CDCl 3 resuena a 32 MHz, en comparación con 300 MHz para los protones en TMS). En los espectros de RMN restantes que veremos en este texto no veremos una señal TMS real, pero siempre podemos suponer que el punto de 0 ppm corresponde a donde resonarían los protones TMS si estuvieran presentes.
Ejemplo
Un protón tiene un desplazamiento químico (relativo a TMS) de 4.56 ppm.
- a) ¿Cuál es su desplazamiento químico, expresado en Hz, en un instrumento de 300 MHz? ¿En un instrumento de 200 MHz?
- b) ¿Cuál es su frecuencia de resonancia, expresada en Hz, en un instrumento de 300 MHz? ¿En un instrumento de 200 MHz?
(Supongamos que en estos instrumentos, los protones TMS resuenan exactamente a 300 o 200 MHz, respectivamente)
Solución
Blindaje diamagnético y deshielding
Llegamos ahora a la pregunta de por qué los protones no equivalentes tienen diferentes cambios químicos. El desplazamiento químico de un protón determinado está determinado principalmente por su entorno electrónico inmediato. Considera la molécula de metano (CH 4), en la que los protones tienen un desplazamiento químico de 0.23 ppm. Los electrones de valencia alrededor del carbono metílico, cuando se someten a B 0, son inducidos a circular y así generar su propio campo magnético muy pequeño que se opone a B 0. Este campo inducido, en un grado pequeño pero significativo, protege a los protones cercanos de experimentar toda la fuerza de B 0, un efecto conocido como blindaje diamagnético local. Por lo tanto, los protones de metano no experimentan toda la fuerza de B 0 -lo que experimentan se llama B eff, o el campo efectivo, que es ligeramente más débil que B 0.
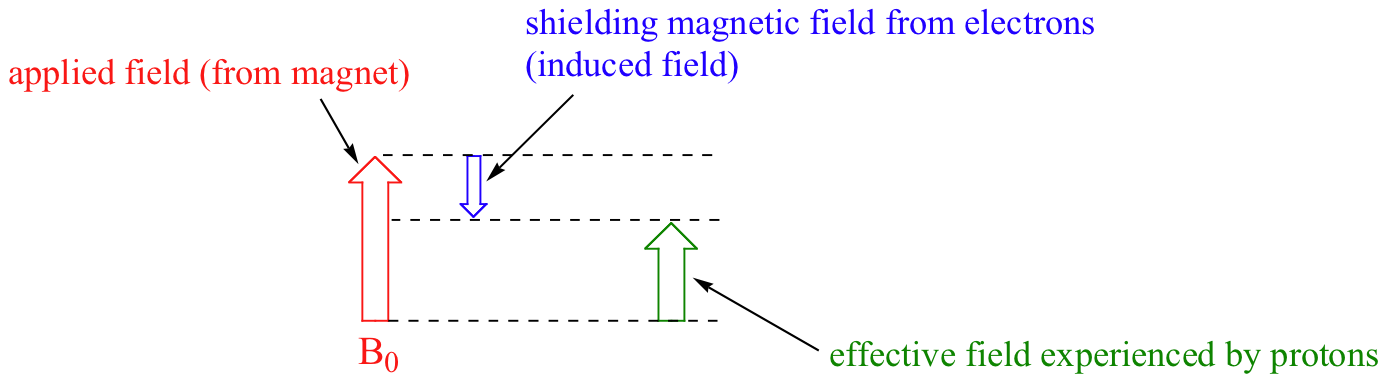
Por lo tanto, su frecuencia de resonancia es ligeramente inferior a lo que sería si no tuvieran electrones cerca para blindarlos.
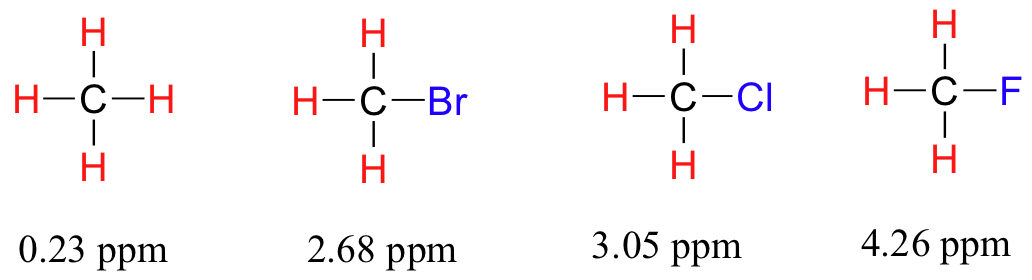
Ahora considere el fluoruro de metilo, CH 3 F, en el que los protones tienen un desplazamiento químico de 4.26 ppm, significativamente mayor que el del metano. Esto es causado por algo llamado el efecto deshielding. Debido a que el flúor es más electronegativo que el carbono, aleja los electrones de valencia del carbono, disminuyendo efectivamente la densidad de electrones alrededor de cada uno de los protones. Para los protones, menor densidad electrónica significa menos blindaje diamagnético, lo que a su vez significa una mayor exposición general a B 0, un eff B más fuerte y una mayor frecuencia de resonancia. Dicho de otra manera, el flúor, al alejar la densidad electrónica de los protones, los está deshielding, dejándolos más expuestos a B 0. A medida que aumenta la electronegatividad del sustituyente, también lo hace el grado de deshielding, y también lo hace el desplazamiento químico. Esto es evidente cuando observamos los cambios químicos del metano y tres compuestos de halometano (recuerde que la electronegatividad aumenta a medida que avanzamos una columna en la tabla periódica).
En gran medida, entonces, podemos predecir tendencias en el cambio químico considerando la cantidad de deshielding que se está produciendo cerca de un protón. El desplazamiento químico del triclorometano es, como se esperaba, mayor que el del diclorometano, que a su vez es mayor que el del clorometano.
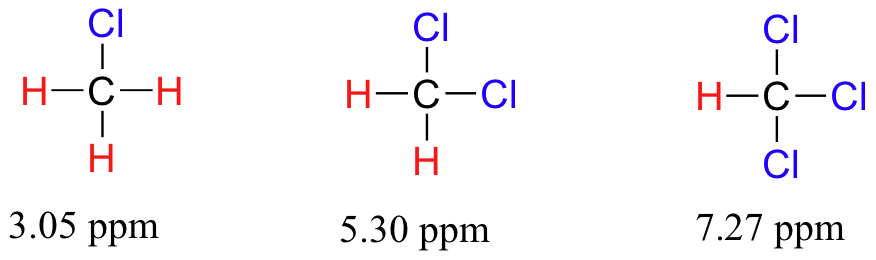
El efecto deshielding de un sustituyente electronegativo disminuye bruscamente con el aumento de la distancia:
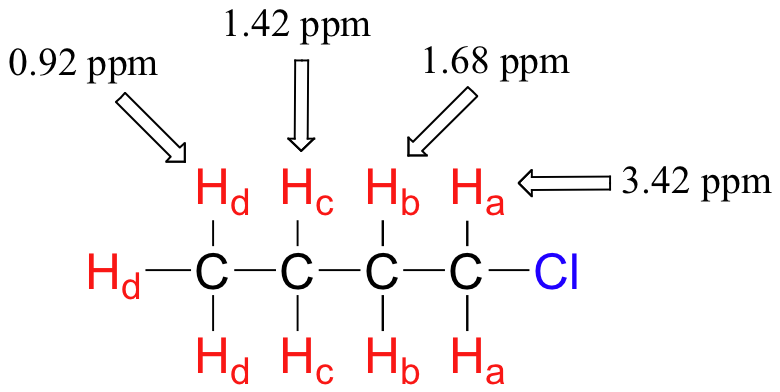
La presencia de un oxígeno electronegativo, nitrógeno, azufre o carbono hibridado sp 2 también tiende a desplazar las señales de RMN de los protones cercanos ligeramente hacia abajo:
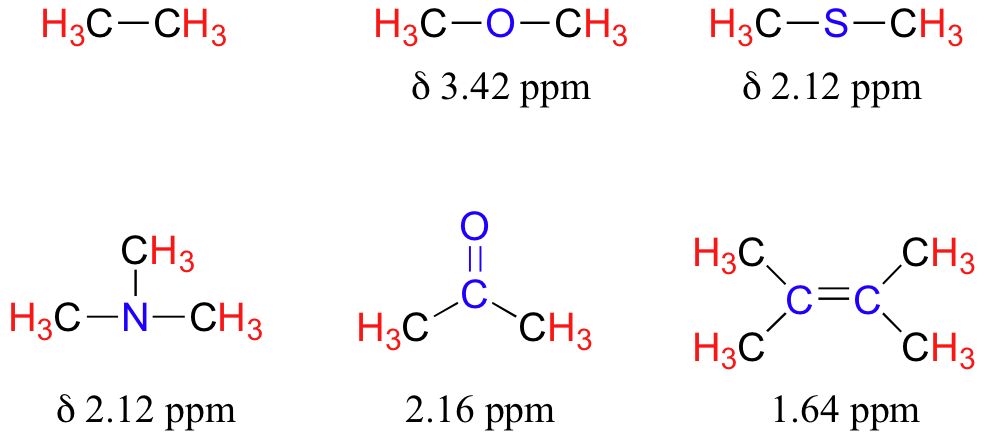
En el Cuadro 2 se enumeran los valores típicos de desplazamiento químico para protones en diferentes ambientes químicos.
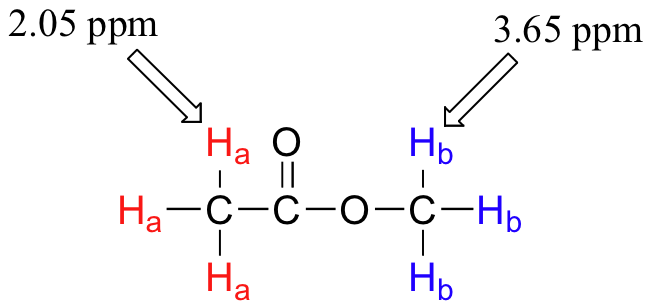
Armados con esta información, finalmente podemos asignar los dos picos en el espectro de 1H-RMN del acetato de metilo que vimos algunas páginas atrás. La señal a 3.65 ppm corresponde a los protones del éster metílico (H b), los cuales son deshirados por el átomo de oxígeno adyacente. La señal de campo superior a 2.05 ppm corresponde a los protones acetato (H a), que es deshibido -pero en menor medida- por el grupo carbonilo adyacente.
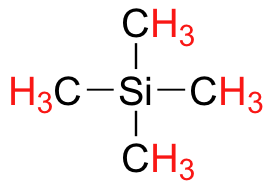
Finalmente, una nota sobre el uso de TMS como estándar en espectroscopía de RMN: una de las principales razones por las que se eligió la señal de protones TMS como punto cero es que los protones TMS están altamente protegidos: el silicio es ligeramente menos electronegativo que el carbono, y por lo tanto dona algunos adicionales densidad de electrones de blindaje. Muy pocas moléculas orgánicas contienen protones con desplazamientos químicos que son negativos en relación con el TMS.
Ejercicio
3. El 2-colorobuteno muestra 4 señales de hidrógeno diferentes. Explique por qué es esto.
- Contestar
-
3. Los mismos colores representan la misma señal. 4 colores diferentes para 4 señales diferentes. El hidrógeno en el alqueno daría dos señales diferentes.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

