12.8: Patrones de división Spin-Spin más complejos
- Page ID
- 76641
Objetivos
Después de completar esta sección, deberías poder
- explicar cómo el acoplamiento múltiple puede dar lugar a espectros de RMN de 1H de aspecto complejo.
- predecir el patrón de división esperado en el espectro de RMN 1H de un compuesto orgánico en el que es posible el acoplamiento múltiple.
- interpretar los espectros de RMN 1H en los que es evidente el acoplamiento múltiple.
Términos Clave
Asegurarse de que se puede definir, y utilizar en contexto, el término clave a continuación.
- diagrama de árbol
Notas de estudio
Vimos los efectos del acoplamiento espín-espín sobre la aparición de una señal de RMN de 1H. Estos efectos pueden complicarse aún más cuando esa señal se acopla a varios protones diferentes. Por ejemplo, BrCH 2 CH 2 CH 2 Cl produciría tres señales. Los hidrógenos en C 1 y C 3 serían cada uno tripletes debido al acoplamiento a los dos hidrógenos en C 2. Sin embargo, el hidrógeno en C 2 “ve” dos conjuntos diferentes de hidrógenos vecinos y, por lo tanto, produciría un triplete de tripletes.
Otro efecto que puede complicar un espectro es la “cercanía” de las señales. Si las señales se superponen por accidente, pueden ser difíciles de identificar. En el ejemplo anterior, esperábamos un triplete de trillizos. Sin embargo, si el acoplamiento es idéntico (o casi idéntico) entre los hidrógenos en C 2 y los hidrógenos tanto en C 1 como en C 3, se observaría un quinteto en el espectro de RMN 1H. [Puede probar esto usted mismo dibujando un diagrama de árbol de un triplete de trillizos asumiendo, primero, diferentes constantes de acoplamiento, y luego, constantes de acoplamiento idénticas.] Tenga en cuenta este punto al interpretar espectros reales de RMN de 1H.
Además, cuando los multipletes están bien separados, forman patrones. Sin embargo, cuando los multipletes se acercan entre sí en el espectro, a veces se distorsionan. Por lo general, los picos internos se vuelven más grandes que los picos externos. Tenga en cuenta los siguientes ejemplos:
Los protones de anillos aromáticos suelen tener señales superpuestas y distorsiones multipletes. A veces no se puede distinguir entre señales individuales, y uno o más multipletes desordenados suelen aparecer en la región aromática.
Es mucho más fácil racionalizar el espectro de RMN de 1H observado de un compuesto conocido que determinar la estructura de un compuesto desconocido a partir de su espectro de RMN 1H. Sin embargo, las racionalizaciones pueden ser una técnica de aprendizaje útil a medida que intenta mejorar su competencia en la interpretación espectral. Recuerda que cuando un químico intenta interpretar el espectro de RMN 1H de un compuesto desconocido, suele tener información adicional disponible para facilitar la tarea. Por ejemplo, es casi seguro que el químico tendrá un espectro infrarrojo del compuesto y posiblemente también un espectro de masas. Los detalles de cómo se sintetizó el compuesto pueden estar disponibles, junto con alguna indicación de sus propiedades químicas, sus propiedades físicas, o ambas.
En los exámenes, se le dará una variedad de información (IR, MS, datos UV y fórmulas empíricas) para que le ayuden con su determinación estructural mediante espectroscopia de RMN 1H. Por ejemplo, se le puede pedir que determine la estructura de C 6 H 12 O dados los siguientes espectros:
Espectro infrarrojo: las absorciones de 3000 cm −1 y 1720 cm −1 son fuertes
| RMN de 1 H | δ (ppm) | Protones | Multiplicidad |
|---|---|---|---|
| 0.87 | 6 | doblete | |
| 1.72 | 1 | multiplete amplio | |
| 2.00 | 3 | singlete | |
| 2.18 | 2 | doblete |
Para responder a esta pregunta, observa que el espectro infrarrojo de C 6 H 12 O muestra $\ ce {\ sf {C-H}} $ estiramiento (3000 cm −1) y $\ ce {\ sf {C-O}} $ estiramiento (1720 cm −1). Ahora hay que juntar la información del espectro de RMN 1H. Observe el singlete con tres protones a 2.00 ppm. Esta señal indica un grupo metilo que no está acoplado a otros protones. Posiblemente podría significar la presencia de un grupo funcional metil cetona.
La señal a 1.72 ppm es un multiplete amplio, lo que sugiere que un carbono con un solo protón está al lado de carbonos con varios protones diferentes.
La señal de doblete a 2.18 ppm implica que un grupo $\ ce {\ sf {-CH2-}} $ está unido a un carbono que tiene solo un protón.
Los seis protones que muestran un doblete a 0.87 ppm indican dos grupos metilo equivalentes unidos a un carbono con un protón.
Siempre que vea una señal en el rango de 0.7-1.3 ppm que es un multiplete de tres protones (3, 6, 9) es muy probable que sea causada por grupos metilo equivalentes.
Usando prueba y error, y con las observaciones anteriores, se debe llegar a la estructura correcta.
Acoplamiento complejo
En todos los ejemplos de acoplamiento espín-espín que hemos visto hasta ahora, la división observada ha resultado del acoplamiento de un conjunto de hidrógenos a solo un conjunto vecino de hidrógenos. Cuando un conjunto de hidrógenos se acopla a dos o más conjuntos de vecinos no equivalentes, el resultado es un fenómeno llamado acoplamiento complejo. Una buena ilustración es proporcionada por el espectro de 1H-RMN del acrilato de metilo:
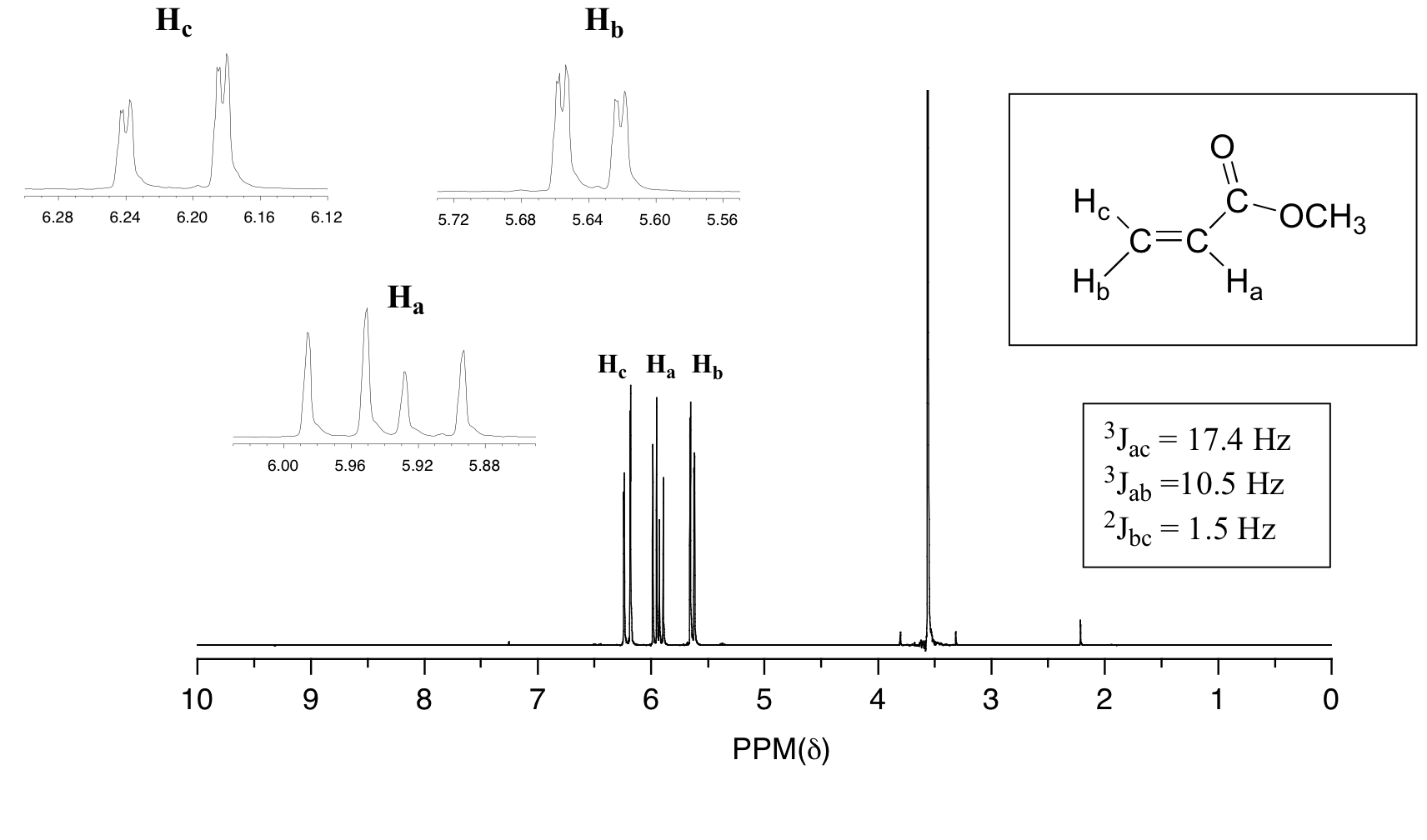 Primero, consideremos primero la señal H c, que se centra en 6.21 ppm. Aquí hay una mirada más cercana:
Primero, consideremos primero la señal H c, que se centra en 6.21 ppm. Aquí hay una mirada más cercana:
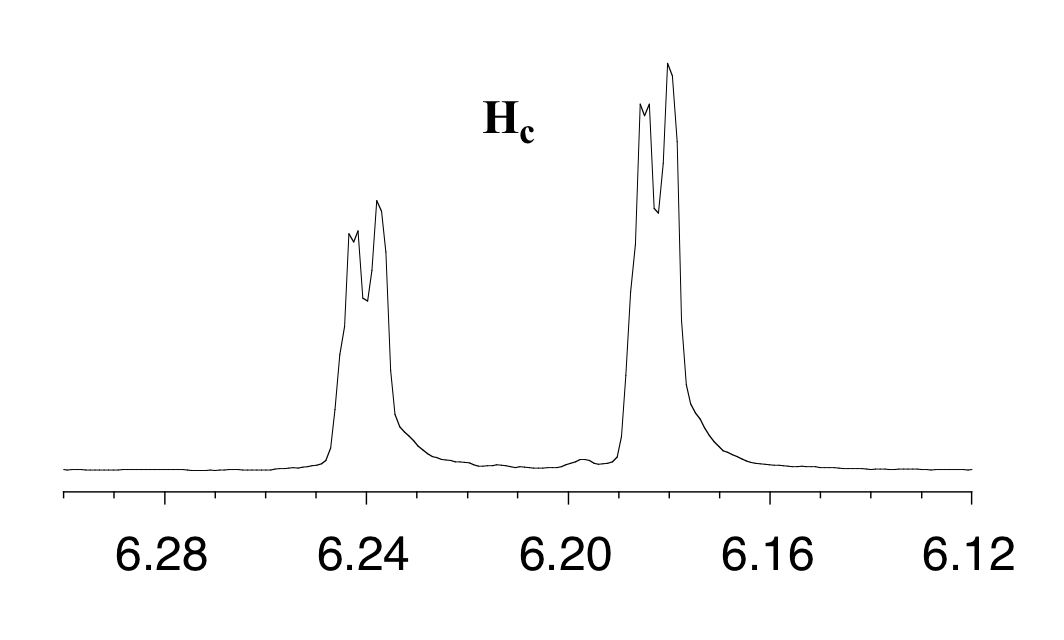
Con esta ampliación, se hace evidente que la señal Hc en realidad está compuesta por cuatro sub-picos. ¿Por qué es esto? H c está acoplado tanto a H a como a H b, pero con dos constantes de acoplamiento diferentes. Una vez más, un diagrama de división (o diagrama de árbol) puede ayudarnos a entender lo que estamos viendo. H a es trans a H c a través del doble enlace, y divide la señal H c en un doblete con una constante de acoplamiento de 3 J ac = 17.4 Hz. Además, cada uno de estos subpicos de doblete H c se divide nuevamente por H b (acoplamiento geminal) en dos dobletes más, cada uno con una constante de acoplamiento mucho menor de 2 J bc = 1.5 Hz.
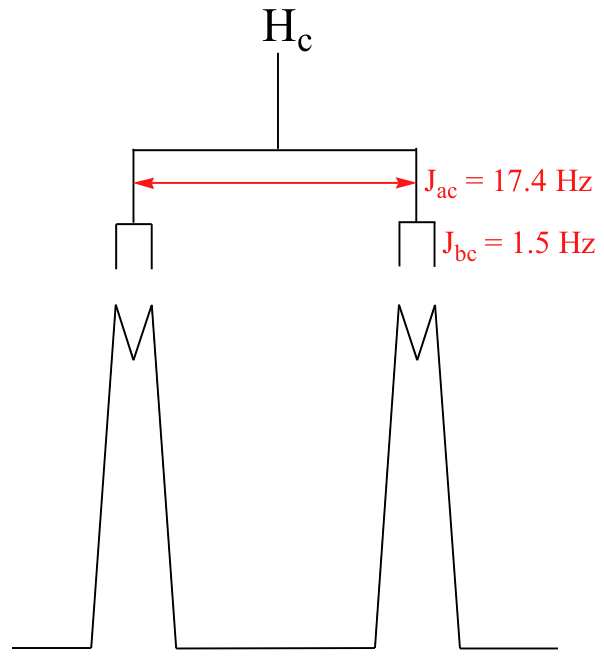
El resultado de esta `doble separación` es un patrón denominado doblete de dobletes, abreviado `dd`.
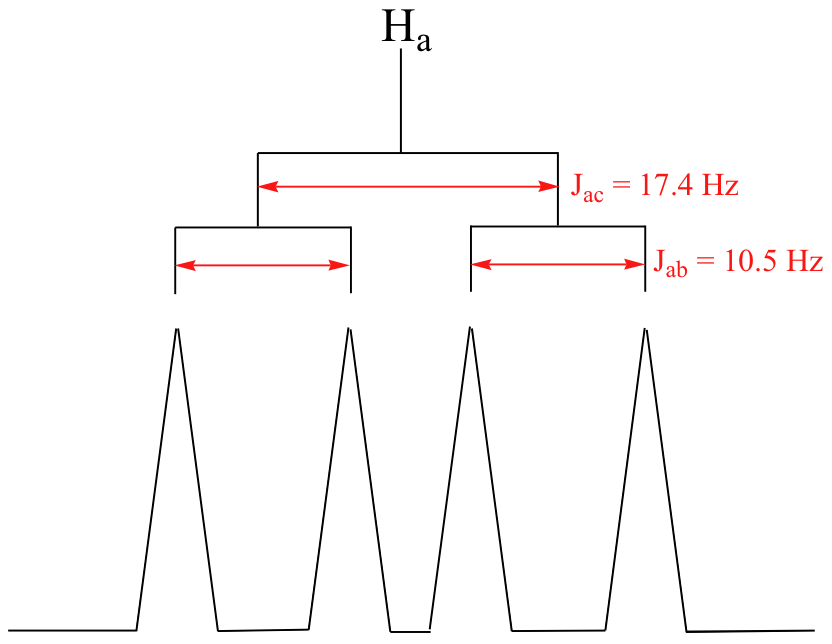
La señal para Ha a 5.95 ppm es también un doblete de dobletes, con constantes de acoplamiento 3 J ac = 17.4 Hz y 3 J ab = 10.5 Hz.
La señal para H b a 5.64 ppm se divide en un doblete por H a, un acoplamiento cis con 3 J ab = 10.4 Hz. Cada uno de los subpicos resultantes se divide de nuevo por H c, con la misma constante de acoplamiento geminal 2 J bc = 1.5 Hz que vimos anteriormente cuando miramos la señal H c. El resultado global es nuevamente un doblete de dobletes, esta vez con los dos `sub-doblets` espaciados ligeramente más cerca debido a la menor constante de acoplamiento para la interacción cis. Aquí hay una voladura de la señal real de H b:
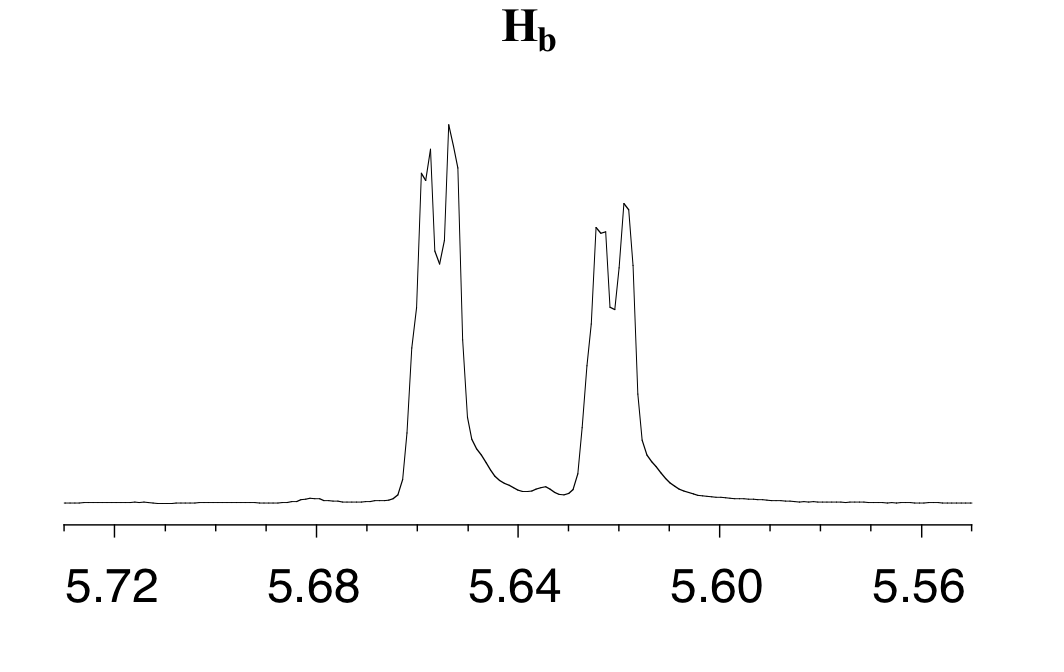
Ejemplo
Construir un diagrama de división para la señal de H b en el espectro de 1H-RMN de acrilato de metilo. Mostrar el valor de desplazamiento químico para cada subpico, expresado en Hz (supongamos que la frecuencia de resonancia del TMS es exactamente de 300 MHz).
Solución
Al construir un diagrama de división para analizar patrones de acoplamiento complejos, generalmente es más fácil mostrar primero la división más grande, seguida de la división más fina (aunque lo contrario daría el mismo resultado final).
Cuando un protón se acopla a dos conjuntos de protones vecinos diferentes con constantes de acoplamiento idénticas o muy cercanas, el patrón de división que emerge a menudo parece seguir la regla simple `n + 1` de división no compleja. En el espectro de 1,1,3-tricloropropano, por ejemplo, esperaríamos que la señal para H b se divida en un triplete por H a, y nuevamente en dobletes por H c, resultando en un 'triplete de dobletes'.
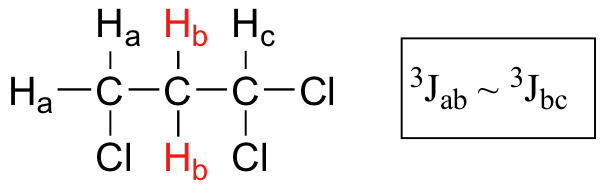
H a y H c no son equivalentes (sus desplazamientos químicos son diferentes), pero resulta que 3 J ab está muy cerca de 3 J bc. Si realizamos un análisis de diagrama de división para H b, vemos que, debido a la superposición de subpicos, la señal parece ser un cuarteto, y para todos los efectos sigue la regla n + 1.
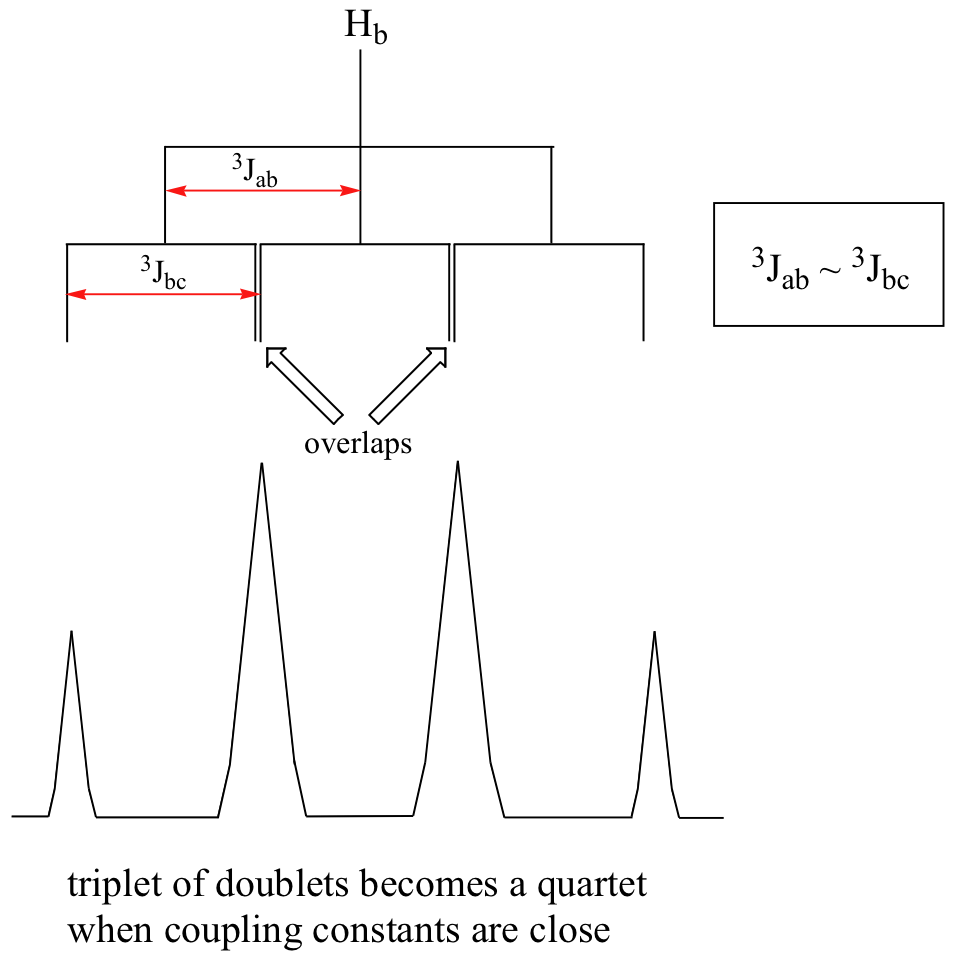
Por razones similares, el pico H c en el espectro de 2-pentanona aparece como un sexteto, dividido por los cinco protones H b y H d combinados. Técnicamente, este 'sexteto' podría considerarse como un 'triplete de cuartetos' con subpicos superpuestos.

En muchos casos, es difícil analizar completamente un patrón de división complejo. En el espectro del tolueno, por ejemplo, si consideramos solo el acoplamiento de 3 enlaces esperaríamos que la señal para H b fuera un doblete, H d un triplete y H c un triplete.
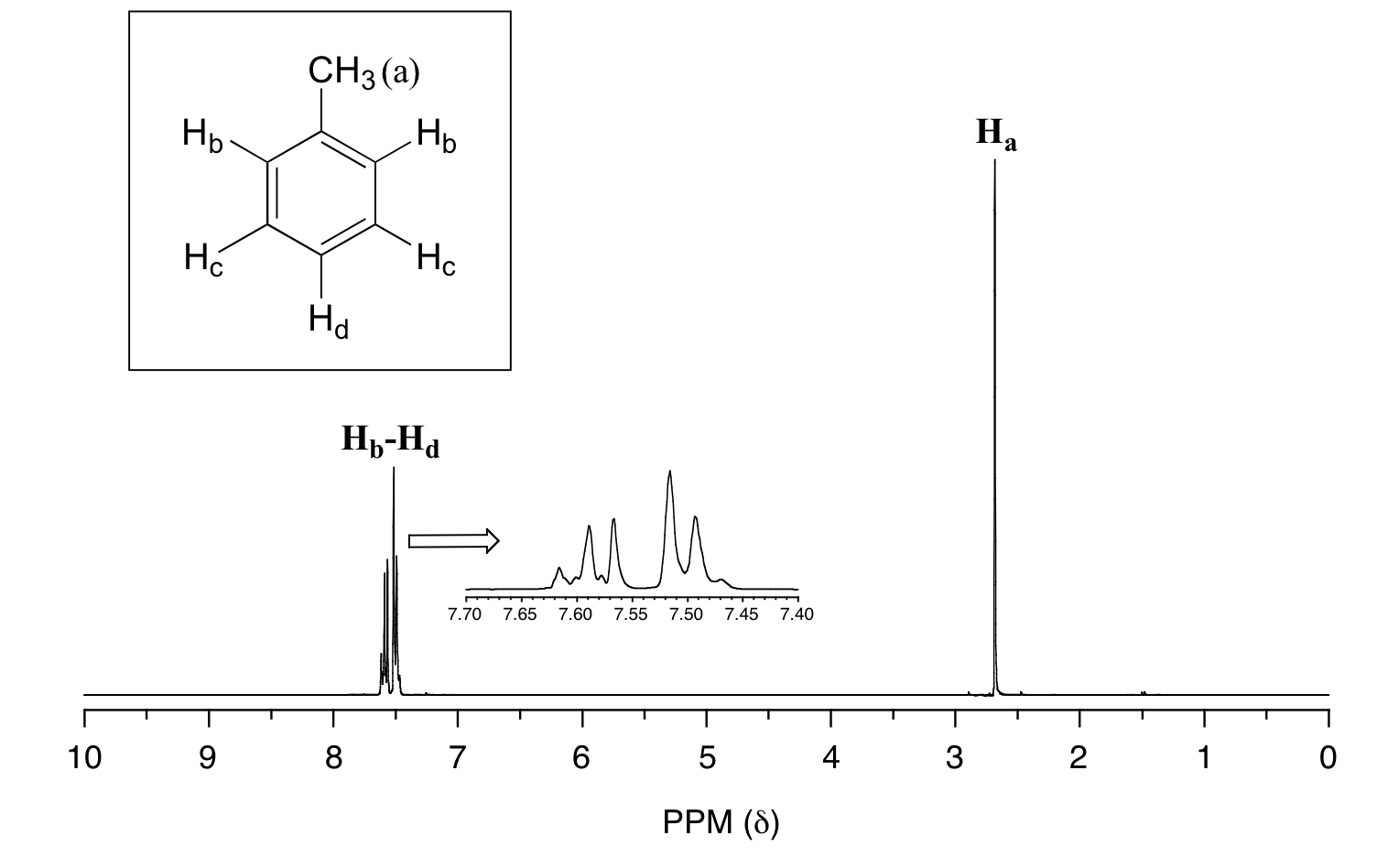
En la práctica, sin embargo, los tres grupos protónicos aromáticos tienen desplazamientos químicos muy similares y sus señales se superponen sustancialmente, dificultando dicho análisis detallado. En este caso, nos referiríamos a la parte aromática del espectro como un multiplete.
Cuando comenzamos a tratar de analizar patrones de división complejos en moléculas más grandes, obtenemos una apreciación de por qué los científicos están dispuestos a pagar grandes sumas de dinero (cientos de miles de dólares) por instrumentos de RMN de campo superior. En pocas palabras, cuanto más fuerte es nuestro imán, más resolución obtenemos en nuestro espectro. En un instrumento de 100 MHz (con un imán de aproximadamente 2.4 Tesla de intensidad de campo), la 'ventana' de frecuencia de 12 ppm en la que podemos observar señales de protones es de 1200 Hz de ancho. En un instrumento de 500 MHz (~12 Tesla), sin embargo, la ventana es de 6000 Hz, cinco veces más ancha. En este sentido, los instrumentos de RMN son como cámaras digitales y televisores de alta definición: una mejor resolución significa más información e imágenes más claras (¡y etiquetas de precio más altas!)
Practica incógnitas
- Dada la siguiente información, dibujar las estructuras de los compuestos A a D.
- Se preparó un compuesto A desconocido como sigue:
Espectro de masas:
pico base m/e = 39 pico
padre m/e = 54Espectro de RMN de 1 H:
δ (ppm) Área Relativa Multiplicidad 1.0 2 triplete 5.4 1 quinteto - El compuesto desconocido B tiene la fórmula molecular C 7 H 6 O 2.
Espectro infrarrojo:
Absorciones de 3200 cm −1 (ancho) y 1747 cm −1 (fuerte)
Espectro de RMN de 1 H:
δ (ppm) Protones 6.9 2 7.4 2 9.8 1 10.9 1 Pista: Las corrientes aromáticas del anillo deshienden todas las señales de protones justo fuera del anillo.
- El compuesto C desconocido no muestra evidencia de instauración y solo contiene carbono e hidrógeno.
Espectro de masas:
pico padre m/e = 68
Espectro de RMN de 1 H:
δ (ppm) Área Relativa Multiplicidad 1.84 3 triplete 2.45 1 septeto Pista: ¡Piensa tridimensionalmente!
- El compuesto desconocido D (C 15 H 14 O) tiene las siguientes propiedades espectrales.
Espectro infrarrojo:
3010 cm −1 (mediano)
1715 cm −1 (fuerte)
1610 cm −1 (fuerte)
1500 cm −1 (fuerte)Espectro de RMN de 1 H:
δ (ppm) Área Relativa Multiplicidad 3.00 2 triplete 3.07 2 triplete 7.1-7.9 10 Multipletes
- Se preparó un compuesto A desconocido como sigue:
RESPUESTAS
13.12 Patrones de división Spin-Spin más complejos
13.12 Ejercicios
Preguntas
Q13.12.1
En la siguiente molécula, el C2 se acopla tanto con el vinilo, C1, como con el alquilo C3. Dibuja el diagrama de árbol de división.

Soluciones
S13.12.1

Ejercicio
13. En la siguiente molécula, el C2 se acopla tanto con el vinilo, C1, como con el alquilo C3. Dibuja el diagrama de árbol de división.

- Contestar
-
13.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

