13.3: Propiedades Físicas de Alcoholes
- Page ID
- 76933
Puntos de ebullición
La siguiente tabla muestra los puntos de ebullición de los siguientes alcoholes primarios simples con hasta 4 átomos de carbono:
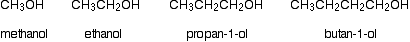
Estos puntos de ebullición se comparan con los de los alcanos equivalentes (metano a butano) con el mismo número de átomos de carbono.
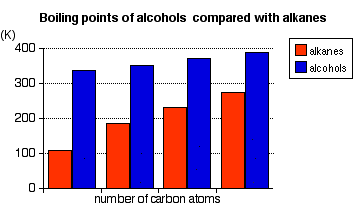
Observe que:
- Los puntos de ebullición de los alcoholes aumentan a medida que aumenta el número de átomos de carbono.
Los patrones en el punto de ebullición reflejan los patrones en las atracciones intermoleculares.
Enlace de hidrógeno
Los enlaces de hidrógeno se producen entre moléculas en las que un átomo de hidrógeno está unido a un elemento fuertemente electronegativo: flúor, oxígeno o nitrógeno. En el caso de los alcoholes, los enlaces de hidrógeno ocurren entre los átomos de hidrógeno parcialmente positivos y los pares solitarios en los átomos de oxígeno de otras moléculas.
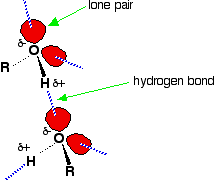
Los átomos de hidrógeno son ligeramente positivos porque los electrones de enlace son atraídos hacia los átomos de oxígeno muy electronegativos. En los alcanos, las únicas fuerzas intermoleculares son las fuerzas de dispersión de van der Waals. Los enlaces de hidrógeno son mucho más fuertes que estos y, por lo tanto, se necesita más energía para separar las moléculas de alcohol que para separar las moléculas de alcano. Esta es la razón principal de mayores puntos de ebullición en los alcoholes.
El efecto de las fuerzas de van der Waals
- Comparación entre alcanos y alcoholes: Incluso sin ningún enlace de hidrógeno o interacciones dipolo-dipolo, el punto de ebullición del alcohol sería mayor que el alcano correspondiente con el mismo número de átomos de carbono.
Compara etano y etanol:
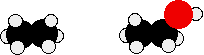
El etanol es una molécula más larga, y el átomo de oxígeno trae consigo 8 electrones adicionales. Ambos aumentan el tamaño de las fuerzas de dispersión de van der Waals, y posteriormente el punto de ebullición. Una medición más precisa del efecto del enlace de hidrógeno sobre el punto de ebullición sería una comparación de etanol con propano en lugar de etano. Las longitudes de las dos moléculas son más similares, y el número de electrones es exactamente el mismo.
Solubilidad de alcoholes en agua
Los alcoholes pequeños son completamente solubles en agua; mezclar los dos en cualquier proporción genera una sola solución. Sin embargo, la solubilidad disminuye a medida que aumenta la longitud de la cadena hidrocarbonada en el alcohol. A cuatro átomos de carbono y más allá, la disminución de la solubilidad es notable; una sustancia de dos capas puede aparecer en un tubo de ensayo cuando las dos se mezclan.
Considera el etanol como un típico alcohol pequeño. Tanto en agua pura como en etanol puro los principales atractivos intermoleculares son los enlaces de hidrógeno.
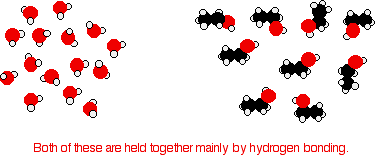
Para mezclar los dos, deben romperse los enlaces de hidrógeno entre las moléculas de agua y los enlaces de hidrógeno entre las moléculas de etanol. Se requiere energía para ambos procesos. Sin embargo, cuando las moléculas se mezclan, se forman nuevos enlaces de hidrógeno entre las moléculas de agua y las moléculas de etanol.
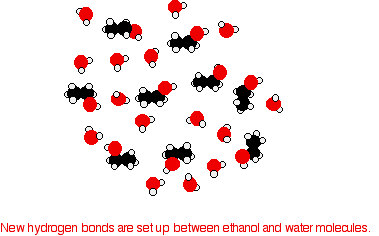
La energía liberada cuando se forman estos nuevos enlaces de hidrógeno compensa aproximadamente la energía necesaria para romper las interacciones originales. Además, hay un incremento en el trastorno del sistema, un incremento en la entropía. Este es otro factor para decidir si ocurren procesos químicos. Considerar una situación hipotética que involucra moléculas de alcohol de 5 carbonos.
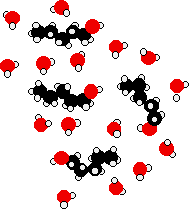
Las cadenas de hidrocarburos son forzadas entre moléculas de agua, rompiendo los enlaces de hidrógeno entre esas moléculas de agua. Los extremos -OH de las moléculas de alcohol pueden formar nuevos enlaces de hidrógeno con moléculas de agua, pero la “cola” de hidrocarburo no forma enlaces de hidrógeno. Esto significa que muchos de los enlaces de hidrógeno originales que se rompen nunca son reemplazados por otros nuevos.
En lugar de esos enlaces de hidrógeno originales se encuentran meramente las fuerzas de dispersión de van der Waals entre el agua y las “colas” de hidrocarburos. Estas atracciones son mucho más débiles, e incapaces de proporcionar suficiente energía para compensar los enlaces de hidrógeno rotos. Incluso permitiendo el aumento del desorden, el proceso se vuelve menos factible. A medida que aumenta la duración del alcohol, esta situación se vuelve más pronunciada, y así la solubilidad disminuye.
Ejercicio
Use 1-octanol y etanol, que se muestran a continuación, para responder a las siguientes preguntas.
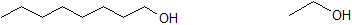
3. ¿Qué compuesto es más soluble en agua?
4. ¿Qué compuesto tiene el punto de ebullición más alto?
5. Explique por qué las respuestas anteriores no están en conflicto usando su comprensión de las fuerzas intermoleculares, los puntos de ebullición relativos y la solubilidad.
- Responder
-
3. etanol
4. octanol
5. Mientras que ambos compuestos presentan enlaces H, la cadena de carbono hidrófoba más pequeña del etanol da como resultado una mayor solubilidad en agua del etanol, mientras que la cadena de carbono más larga de octanol aumenta el área superficial, lo que resulta en un punto de ebullición más alto.
Colaboradores
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Jim Clark (Chemguide.co.uk)
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. This content is copyrighted under the following conditions, "You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format."

