13.4: Espectroscopia de Alcoholes
- Page ID
- 76932
Espectroscopía Infrarroja
Si miras un espectro IR de 1-butanol, verás:
- hay modos de estiramiento sp 3 C-H y flexión CH 2 a 2900 y 1500 cm -1.
- hay un fuerte modo de estiramiento C-O cerca de 1000 cm -1.
- hay un pico muy grande alrededor de 3400 cm -1. Los picos O-H suelen ser muy amplios como este.
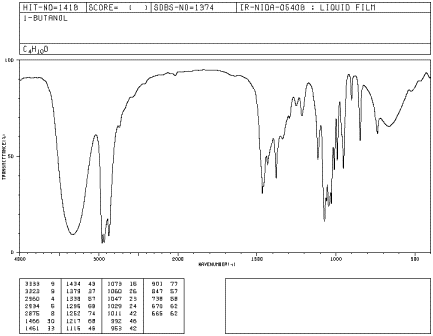
Las formas de los picos a veces son muy útiles para reconocer qué tipo de vínculo está presente. La forma redondeada de la mayoría de los modos de estiramiento O-H ocurre debido a los enlaces de hidrógeno entre diferentes grupos hidroxi. Debido a que los protones se comparten en medida variable con los oxígenos vecinos, los enlaces O-H covalentes en una muestra de alcohol vibran a frecuencias ligeramente diferentes y se muestran en posiciones ligeramente diferentes en el espectro IR. En lugar de ver un pico agudo, ves muchos de ellos todos manchados en una mancha ancha. Dado que los enlaces C-H no hacen enlaces de hidrógeno muy bien, no se ve ese fenómeno en un éter, y un pico O-H es muy fácil de distinguir en el espectro IR.
Espectroscopía de Resonancia Magnética
Alcoholes 
¿Dónde está el pico -O-H? ¡Esto es muy confuso! Diferentes fuentes citan desplazamientos químicos totalmente diferentes para el átomo de hidrógeno en el grupo -OH en alcoholes, a menudo de manera inconsistente. Por ejemplo:
- El libro de datos de Nuffield cita 2.0 - 4.0, pero el libro de texto Nuffield muestra un pico en aproximadamente 5.4.
- La Ficha Técnica de OCR para su uso en sus exámenes cita 3.5 - 5.5.
- Un libro de texto de química orgánica de nivel de grado confiable cita 1.0 - 5.0, pero luego muestra un espectro de RMN para etanol con un pico en aproximadamente 6.1.
- La base de datos SDBS (utilizada en todo este sitio) da el pico -OH en etanol a aproximadamente 2.6.
El problema parece ser que la posición del pico -OH varía drásticamente dependiendo de las condiciones -por ejemplo, qué disolvente se usa, la concentración y la pureza del alcohol- especialmente de si está o no totalmente seco.
Una forma inteligente de elegir el pico -OH 
Si mide un espectro de RMN para un alcohol como el etanol, y luego agrega unas gotas de óxido de deuterio, D 2 O, a la solución, deja que se asiente y luego vuelve a medir el espectro, ¡el pico -OH desaparece! Al comparar los dos espectros, se puede decir inmediatamente qué pico se debió al grupo -OH.
La razón de la pérdida del pico radica en la interacción entre el óxido de deuterio y el alcohol. Todos los alcoholes, como el etanol, son muy, muy ligeramente ácidos. El hidrógeno en el grupo -OH se transfiere a uno de los pares solitarios en el oxígeno de la molécula de agua. El hecho de que aquí tengamos “agua pesada” no hace ninguna diferencia en eso.
El ion negativo formado es más probable que choque con una simple molécula de óxido de deuterio para regenerar el alcohol, excepto que ahora el grupo -OH se ha convertido en un grupo -OD.
Los átomos de deuterio no producen picos en la misma región de un espectro de RMN que los átomos de hidrógeno ordinarios, por lo que el pico desaparece. Quizás te preguntes qué pasa con el ion positivo en la primera ecuación y el OD, en la segunda. Éstas se pierden en el equilibrio normal que existe dondequiera que se tengan moléculas de agua, pesadas o no.
\[2D_2O \rightleftharpoons D_3O^+ + OH^-\]
La falta de división con grupos -OH 
A menos que el alcohol esté absolutamente libre de agua, el hidrógeno en el grupo -OH y cualquier hidrógeno en el carbono de al lado no interactúan para producir ninguna división. El pico -OH es un singlete y no tienes que preocuparte por su efecto en los hidrógenos de al lado.
El cúmulo de picos de la izquierda se debe al grupo CH 2. Se trata de un cuarteto por los 3 hidrógenos del grupo CH 3 de al lado. Se puede ignorar el efecto del hidrógeno -OH. De manera similar, el pico -OH en la mitad del espectro es un singlete. No se ha convertido en triplete por la influencia del grupo CH 2.
Patrones de fragmentación de espectros 
La fragmentación de iones moleculares en una variedad de iones fragmentos es una bendición mixta. La naturaleza de los fragmentos a menudo proporciona una pista de la estructura molecular, pero si el ion molecular tiene una vida útil de menos de unos pocos microsegundos no sobrevivirá lo suficiente como para ser observado. Sin un pico de iones moleculares como referencia, la dificultad de interpretar un espectro de masas aumenta notablemente. Afortunadamente, la mayoría de los compuestos orgánicos dan espectros de masas que incluyen un ion molecular, y aquellos que no suelen responder con éxito al uso de condiciones de ionización más suaves. Entre los compuestos orgánicos simples, los iones moleculares más estables son los de anillos aromáticos, otros sistemas de electrones piconjugados y cicloalcanos. Los alcoholes, éteres y alcanos altamente ramificados generalmente muestran la mayor tendencia hacia la fragmentación.
La presencia de un grupo funcional, particularmente uno que tiene un heteroátomo Y con electrones de valencia no enlazantes (Y = N, O, S, X etc.), puede alterar drásticamente el patrón de fragmentación de un compuesto. Se cree que esta influencia ocurre debido a una “localización” del componente catión radical del ion molecular en el heteroátomo. Después de todo, es más fácil eliminar (ionizar) un electrón no enlazante que uno que forma parte de un enlace covalente. Al localizar el resto reactivo, se favorecerán ciertos procesos de fragmentación. Estos se resumen en el siguiente diagrama, donde la caja sombreada verde en la parte superior muestra ejemplos de tales iones moleculares “localizados”. Las dos primeras trayectorias de fragmentación conducen a iones pares de electrones, y la eliminación (ruta #3) da un ion de electrones impares. Tenga en cuenta el uso de diferentes flechas curvas para mostrar desplazamientos de electrones individuales en comparación con los desplazamientos de pares de electrones.
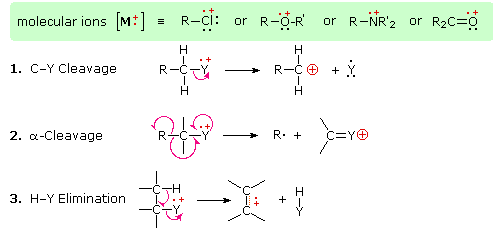
El 3-Pentanol muestra tres iones fragmentos significativos. La fragmentación alfa (pérdida de un radical etilo) forma el pico base m/z=59. La pérdida de agua de esto da un fragmento m/z=41, y la pérdida de eteno a partir de m/z=59 da un fragmento m/z=31.
Ejercicio
6. A partir del análisis de espectroscopía de masas se determinó que un compuesto tiene la fórmula general C 5 H 12 O. Dado el siguiente espectro de RMN de 1H, dibujar la estructura. Los valores de integración de cada grupo de señales se dan en el espectro.
7. Dado que los alcoholes son relativamente ácidos y los protones se transfieren en solución, ¿qué esperarías que sucediera con el espectro de RMN si se usara D 2 O como disolvente?
8. A partir del análisis de espectroscopía de masas se determinó que un compuesto tiene la fórmula general C3H 8 O. Dado el siguiente espectro de RMN de 1H, dibujar la estructura. Los valores de integración de cada grupo de señales se dan en el espectro.
- Contestar
-
6.

7.
Se esperaría que la intensidad de la señal de protones de alcohol en la RMN 1H disminuyera y probablemente desapareciera. Esto se debe a que la RMN solo puede sondear los cambios de espín de núcleos con un número impar de protones.
8.
1-propanol

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

