13.5: Acidez de Alcoholes y Fenoles
- Page ID
- 76883
Descripción general - Solventes Acuosos vs Orgánicos
En soluciones acuosas, los fenoles son débilmente ácidos y disminuyen el pH de una solución. El hidróxido de sodio se puede usar para desprotonar completamente un fenol. Los alcoholes solubles en agua no cambian el pH de la solución y se consideran neutros. Las soluciones acuosas de hidróxido de sodio NO pueden desprotonar alcoholes a una concentración lo suficientemente alta como para ser sintéticamente útiles.
En soluciones de solventes orgánicos, se pueden crear condiciones de reacción más extremas. El metal de sodio se puede agregar a un alcohol en un sistema de solvente orgánico para desprotonar completamente el alcohol para formar iones alcóxido.
Acidez de Alcoholes
Varias reacciones químicas importantes de alcoholes que involucran el enlace O-H o enlace oxígeno-hidrógeno solo y dejan intacto el enlace carbono-oxígeno. Un ejemplo importante es la formación de sal con ácidos y bases. Los alcoholes, como el agua, son tanto bases débiles como ácidos débiles. La constante de ionización ácida (Ka) del etanol es de aproximadamente 10~18, ligeramente menor que la del agua. El etanol se puede convertir a su base conjugada por la base conjugada de un ácido más débil como el amoníaco {Ka — 10~35), o hidrógeno (Ka ~ 10-38). Es conveniente emplear metal de sodio o hidruro de sodio, que reaccionan vigorosamente pero de manera controlable con alcoholes:
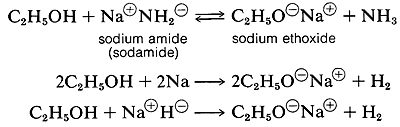
El orden de acidez de varios alcoholes líquidos generalmente es agua > primario > secundario > ROH terciario. Con esto queremos decir que la posición de equilibrio para la reacción de transferencia de protones se encuentra más en el lado de ROH ya que R se cambia de primaria a secundaria a terciaria; por lo tanto, el alcohol terc-butílico se considera menos ácido que el etanol:
\[ ROH + OH^- \rightleftharpoons RO^- + HOH\]
However, in the gas phase the order of acidity is reversed, and the equilibrium position for lies increasingly on the side of the alkoxide as R is changed from primary to secondary to tertiary, tert-butyl alcohol is therefore more acidic than ethanol in the gas phase. This seeming contradiction appears more reasonable when one considers what effect solvation (or the lack of it) has on equilibria. In solution, the larger alkoxide ions, probably are less well solvated than the smaller ions, because fewer solvent molecules can be accommodated around the negatively charged oxygen in the larger ions:
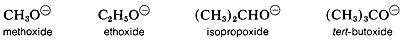
La acidez de los alcoholes disminuye a medida que aumenta el tamaño de la base conjugada. Sin embargo, los iones gaseosos “desnudos” son más estables cuanto más grandes son los grupos R asociados, probablemente porque los grupos R más grandes pueden estabilizar la carga en el átomo de oxígeno mejor que los grupos R más pequeños. Lo hacen por polarización de sus electrones de unión, y cuanto más grande es el grupo, más polarizable es.
Basicidad de los Alcoholes
Los alcoholes son bases similares en fuerza al agua y aceptan protones de ácidos fuertes. Un ejemplo es la reacción de metanol con bromuro de hidrógeno para dar bromuro de metiloxonio, que es análogo a la formación de bromuro de hidroxonio con bromuro de hidrógeno y agua:
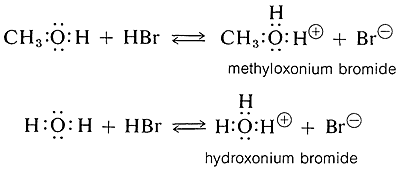
Acidez del fenol
Los compuestos como alcoholes y fenol que contienen un grupo -OH unido a un hidrocarburo son ácidos muy débiles. Los alcoholes son tan débilmente ácidos que, para fines normales de laboratorio, su acidez puede ser prácticamente ignorada. Sin embargo, el fenol es lo suficientemente ácido para que tenga propiedades reconocibles ácidas, aunque todavía sea un ácido muy débil. Un ion hidrógeno puede separarse del grupo -OH y transferirse a una base. Por ejemplo, en solución en agua:

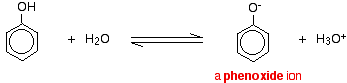
El fenol es un ácido muy débil y la posición de equilibrio se encuentra bien a la izquierda. El fenol puede perder un ion hidrógeno porque el ion fenóxido formado se estabiliza en cierta medida. La carga negativa en el átomo de oxígeno se deslocaliza alrededor del anillo. Cuanto más estable es el ion, más probable es que se forme. Uno de los pares solitarios en el átomo de oxígeno se solapa con los electrones deslocalizados en el anillo de benceno.
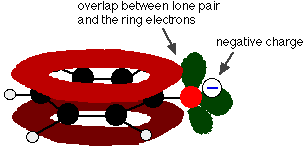
Esta superposición conduce a una deslocalización que se extiende desde el anillo hacia fuera sobre el átomo de oxígeno. Como resultado, la carga negativa ya no se localiza completamente en el oxígeno, sino que se extiende alrededor de todo el ion.
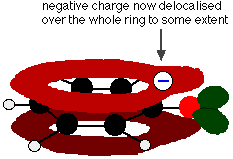
La dispersión de la carga alrededor hace que el ion sea más estable de lo que sería si toda la carga permaneciera en el oxígeno. Sin embargo, el oxígeno es el elemento más electronegativo en el ion y los electrones deslocalizados serán atraídos hacia él. Eso significa que todavía habrá mucha carga alrededor del oxígeno que tenderá a atraer nuevamente al ion hidrógeno. Es por ello que el fenol es sólo un ácido muy débil.
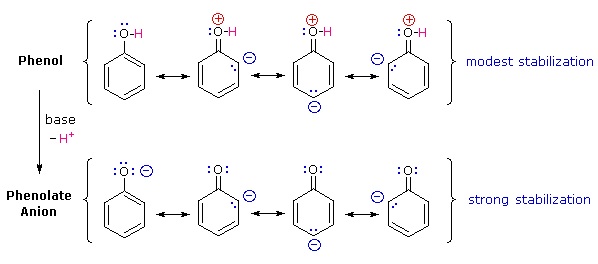
¿Por qué el fenol es un ácido mucho más fuerte que el ciclohexanol? Para responder a esta pregunta debemos evaluar la manera en que un sustituyente de oxígeno interactúa con el anillo de benceno. Como se señaló en nuestro tratamiento anterior de reacciones de sustitución aromática electrofílica, un sustituyente de oxígeno potencia la reactividad del anillo y favorece el ataque electrófilo en los sitios orto y para. Se propuso que la deslocalización por resonancia de un par de electrones no enlazados de oxígeno en el sistema de electrones pi-del anillo aromático fue responsable de este efecto sustituyente. Un conjunto similar de estructuras de resonancia para la base conjugada de anión fenolato aparece debajo de las estructuras de fenol.
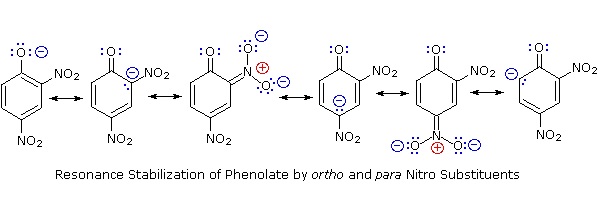
La estabilización de resonancia en estos dos casos es muy diferente. Un principio importante de resonancia es que la separación de cargas disminuye la importancia de los contribuyentes canónicos al híbrido de resonancia y reduce la estabilización general. Todas las estructuras contribuyentes al híbrido fenólico sufren separación de carga, lo que resulta en una estabilización muy modesta de este compuesto. Por otro lado, el anión fenolato ya está cargado, y los contribuyentes canónicos actúan para dispersar la carga, resultando en una estabilización sustancial de esta especie. Las bases conjugadas de los alcoholes simples no se estabilizan por deslocalización de carga, por lo que la acidez de estos compuestos es similar a la del agua. A la derecha se muestra un diagrama de energía que muestra el efecto de la resonancia sobre las acideces de ciclohexanol y fenol. Dado que la estabilización por resonancia de la base conjugada de fenolato es mucho mayor que la estabilización del propio fenol, se incrementa la acidez del fenol respecto al ciclohexanol. La evidencia de que la carga negativa de fenolato está deslocalizada en los carbonos orto y para del anillo de benceno proviene de la influencia de sustituyentes aceptores de electrones en esos sitios.

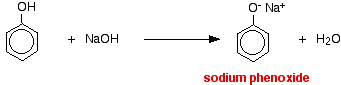
En esta reacción, el ion hidrógeno ha sido eliminado por el ion hidróxido fuertemente básico en la solución de hidróxido de sodio.
Los ácidos reaccionan con los metales más reactivos para dar gas hidrógeno. El fenol no es la excepción; la única diferencia es la reacción lenta porque el fenol es un ácido tan débil. El fenol se calienta en un tubo seco hasta que se funde, y se agrega un pequeño trozo de sodio. Hay algo de efervamiento a medida que se desprende gas hidrógeno. La mezcla que quede en el tubo contendrá fenóxido de sodio.

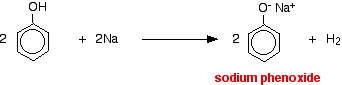
Acidez de Fenoles Sustituidos
La sustitución del átomo de hidrógeno hidroxilo es aún más facil con fenoles, que son aproximadamente un millón de veces más ácidos que los alcoholes equivalentes. Esta acidez fenólica se ve potenciada aún más por los sustituyentes aceptores de electrones orto y para al grupo hidroxilo, como se muestra en el siguiente diagrama. El alcohol ciclohexanol se muestra como referencia en la parte superior izquierda. Es de destacar que la influencia de un sustituyente nitro es más de diez veces más fuerte en la para-localización que en meta, a pesar de que esta última posición está más cerca del grupo hidroxilo. Además, los grupos nitro adicionales tienen una influencia aditiva si se colocan en ubicaciones orto o para. El compuesto trinitro que se muestra en la parte inferior derecha es un ácido muy fuerte llamado ácido pícrico.
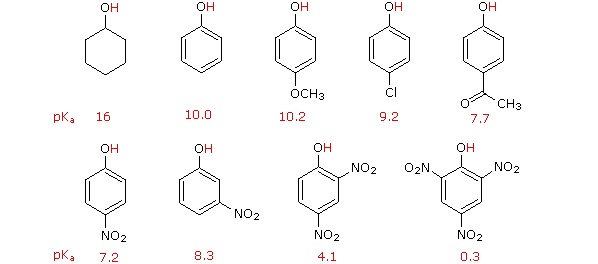
Comparando la Acidez de Alcoholes con Fenoles
¿Por qué el fenol es un ácido mucho más fuerte que el ciclohexanol? Para responder a esta pregunta debemos evaluar la manera en que un sustituyente de oxígeno interactúa con el anillo de benceno. Como se señaló en nuestro tratamiento anterior de reacciones de sustitución aromática electrofílica, un sustituyente de oxígeno potencia la reactividad del anillo y favorece el ataque electrófilo en los sitios orto y para. Se propuso que la deslocalización por resonancia de un par de electrones no enlazados de oxígeno en el sistema de electrones pi-del anillo aromático fue responsable de este efecto sustituyente. Las fórmulas que ilustran esta deslocalización de electrones se mostrarán cuando se haga clic en el botón “Estructuras de resonancia” debajo del diagrama anterior. Un conjunto similar de estructuras de resonancia para la base conjugada de anión fenolato aparece debajo de las estructuras de fenol.
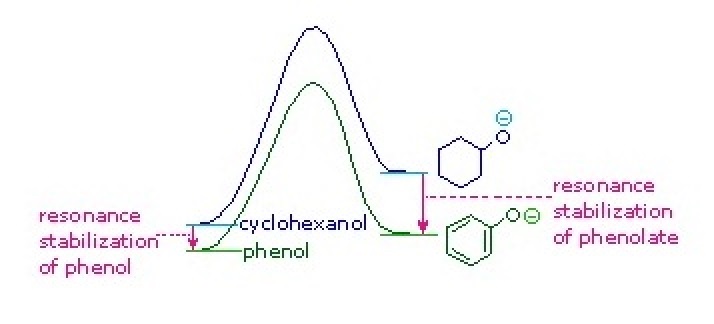
La estabilización de resonancia en estos dos casos es muy diferente. Un principio importante de resonancia es que la separación de cargas disminuye la importancia de los contribuyentes canónicos al híbrido de resonancia y reduce la estabilización general. Todas las estructuras contribuyentes al híbrido fenólico sufren separación de carga, lo que resulta en una estabilización muy modesta de este compuesto. Por otro lado, el anión fenolato ya está cargado, y los contribuyentes canónicos actúan para dispersar la carga, resultando en una estabilización sustancial de esta especie. Las bases conjugadas de los alcoholes simples no se estabilizan por deslocalización de carga, por lo que la acidez de estos compuestos es similar a la del agua. A la derecha se muestra un diagrama de energía que muestra el efecto de la resonancia sobre las acideces de ciclohexanol y fenol. Dado que la estabilización por resonancia de la base conjugada de fenolato es mucho mayor que la estabilización del propio fenol, se incrementa la acidez del fenol respecto al ciclohexanol. La evidencia de que la carga negativa de fenolato está deslocalizada en los carbonos orto y para del anillo de benceno proviene de la influencia de sustituyentes que retiran electrones en esos sitios.
Ejercicio
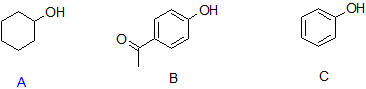
9. Organice los siguientes compuestos en orden de acidez decreciente cuando estén en solución.
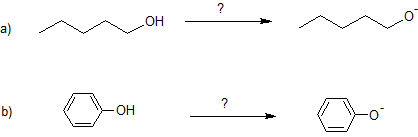
10. Especificar la base necesaria para desprotonar cada reactivo.
- Contestar
-
9. B > C > A
10. a) Na o NaH o NNH 2
b) NaOH o KOH o LiOH
Colaboradores
Prof. Steven Farmer (Sonoma State University)
Jim Clark (Chemguide.co.uk)

