14.4: Reacciones de deshidratación de alcoholes
- Page ID
- 76382
Deshidratación de alcoholes para producir alquenos
Una forma de sintetizar alquenos es mediante deshidratación de alcoholes, proceso en el que los alcoholes experimentan mecanismos E1 o E2 para perder agua y formar un doble enlace. La reacción de deshidratación de alcoholes para generar alqueno procede calentando los alcoholes en presencia de un ácido fuerte, como ácido sulfúrico o fosfórico, a altas temperaturas.
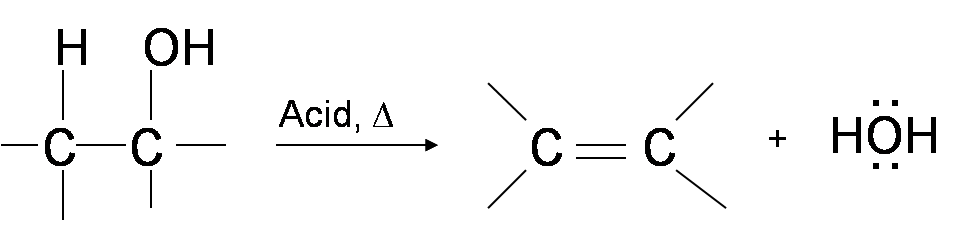
El intervalo requerido de temperatura de reacción disminuye con el aumento de la sustitución del carbono que contiene hidroxi:
- Alcoholes 1°: 170° - 180°C
- 2° alcoholes: 100°— 140 °C
- 3° alcoholes: 25°— 80°C
Si la reacción no se calienta suficientemente, los alcoholes no se deshidratan para formar alquenos, sino que reaccionan entre sí para formar éteres (por ejemplo, la Síntesis de Éter de Williamson).

Los alcoholes son anfóteros; pueden actuar como ácidos o como base. El par solitario de electrones en el átomo de oxígeno hace que el grupo —OH sea débilmente básico. El oxígeno puede donar dos electrones a un protón deficiente en electrones. Así, en presencia de un ácido fuerte, R—OH actúa como base y protona en el ion alquiloxonio muy ácido +OH2 (El valor pKa de un alcohol protonado terciario puede ir tan bajo como -3.8). Esta característica básica del alcohol es esencial para su reacción de deshidratación con un ácido para formar alquenos.
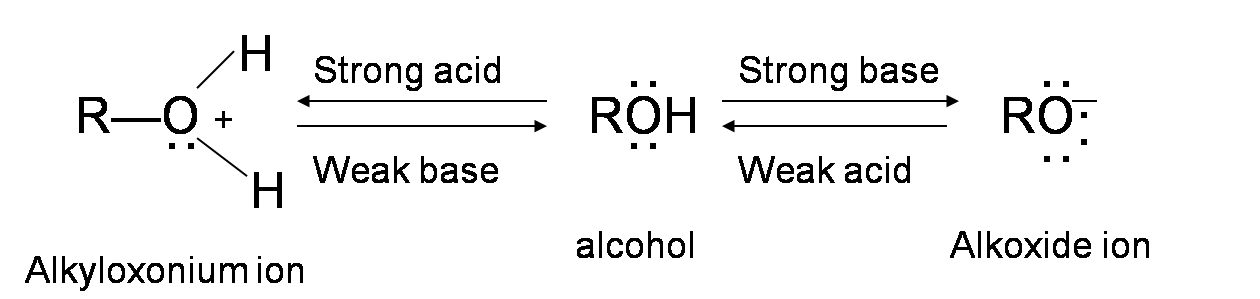
Mecanismo para la Deshidratación del Alcohol en Alqueno
Diferentes tipos de alcoholes pueden deshidratarse a través de una vía de mecanismo ligeramente diferente. Sin embargo, la idea general detrás de cada reacción de deshidratación es que el grupo —OH en el alcohol dona dos electrones a H + del reactivo ácido, formando un ion alquiloxonio. Este ion actúa como un muy buen grupo de salida que deja para formar un carbocatión. El ácido desprotonado (la base) reacciona entonces con el hidrógeno adyacente al carbocatión y forma un doble enlace.
Los alcoholes primarios experimentan eliminación bimolecular (mecanismo E2) mientras que los alcoholes secundarios y terciarios experimentan eliminación unimolecular (mecanismo E1). La reactividad relativa de los alcoholes en las reacciones de deshidratación se clasifica de la siguiente manera:
Metanol < primario < secundario < terciario
Los alcoholes primarios se deshidratan a través del mecanismo E2. El oxígeno hidroxílico dona dos electrones a un protón a partir de ácido sulfúrico (H 2 SO 4), formando un ion alquiloxonio. Entonces la base conjugada, HSO 4 —, reacciona con uno de los átomos de hidrógeno adyacentes (beta) mientras que el ion alquiloxonio sale en un proceso concertado, formando un doble enlace.

Los alcoholes secundarios y terciarios se deshidratan a través del mecanismo E1. De manera similar a la reacción anterior, secundario y terciario —OH protonato para formar iones alquiloxonio. Sin embargo, en este caso el ion sale primero y forma un carbocatión como intermedio de reacción. La molécula de agua (que es una base más fuerte que el ion HSO 4 -) luego abstrae un protón de un carbono adyacente para formar un doble enlace. Observe en el siguiente mecanismo que el alqueno formado depende de qué protón se abstrae: las flechas rojas muestran la formación del 2-buteno más sustituido, mientras que las flechas azules muestran la formación del 1-buteno menos sustituido. Recordemos que según la Regla de Zaitsev, los alquenos más sustituidos se forman preferentemente porque son más estables que los alquenos menos sustituidos. Adicionalmente, los alquenos trans son más estables que los alquenos cis y también son el producto principal formado. Para el ejemplo siguiente, el diastereómero trans del producto 2-buteno es el más abundante.
Reacción de deshidratación del alcohol secundario
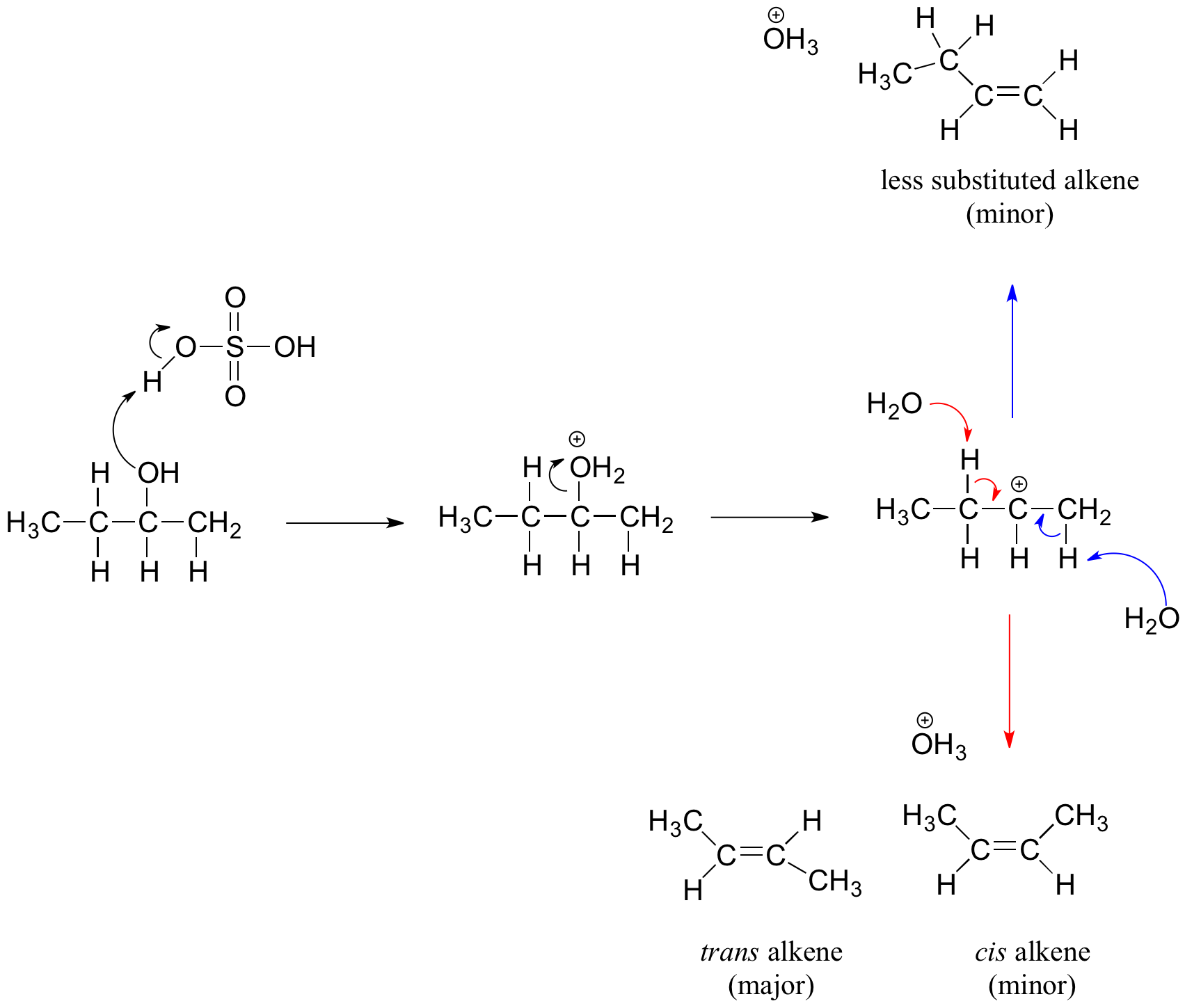
El mecanismo de deshidratación para un alcohol terciario es análogo al mostrado anteriormente para un alcohol secundario.
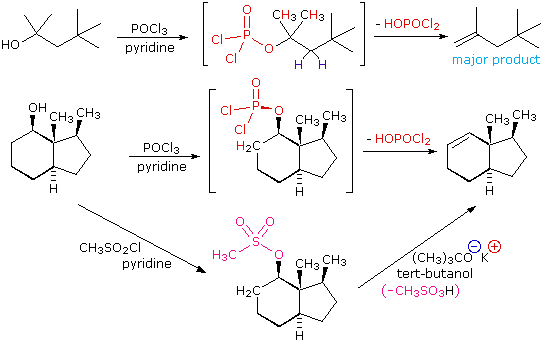
La eliminación E2 de 3º-alcoholes en condiciones relativamente no ácidas se puede lograr mediante el tratamiento con oxicloruro de fósforo (POCl 3) en piridina. Este procedimiento también es efectivo con 2º-alcoholes impedidos, pero para los alcoholes sin impedimentos y 1º-alcoholes una sustitución de iones cloruro S N 2 del intermedio clorofosfato compite con la eliminación. Ejemplos de estas y reacciones relacionadas se dan en la siguiente figura. La primera ecuación muestra la deshidratación de un 3º-alcohol. El predominio del producto no Zaitsev (doble enlace menos sustituido) se presume debido al impedimento estérico de los átomos de hidrógeno del grupo metileno, lo que interfiere con la aproximación de la base en ese sitio. El segundo ejemplo muestra dos procedimientos de eliminación aplicados al mismo 2º-alcohol. El primero utiliza el método PoCl3 de un solo paso, que funciona bien en este caso porque la sustitución de SN2 es retardada por impedimento estérico. El segundo método es otro ejemplo en el que un éster sulfonato intermedio confiere reactividad de tipo halógeno a un alcohol. En todos los casos el grupo eliminable aniónico es la base conjugada de un ácido fuerte.
Problemas de práctica (también conocido como Ejercicios)

.jpg)
Ejercicios
6. Comenzando con ciclohexanol, describa cómo prepararía el ciclohexeno.
7. En la deshidratación del 1-metilciclohexanol, ¿qué producto es favorecido?

8.
En la deshidratación de este diol el producto resultante es una cetona. Dibujar el mecanismo de su formación. (Insinuar que se produce un reordenamiento)

9.
Dibuje un mecanismo de empuje de flecha para la deshidratación catalizada por ácido del siguiente alcohol, asegúrese de dibujar ambos mecanismos potenciales. Asumir que no hay reorganización para los dos primeros mecanismos del producto. ¿Cuál de estos dos probablemente sería el producto principal? Si hubo un reordenamiento, dibuje el producto mayor esperado.

Responder
-
6. H 2 SO 4 con calor ya que no hay preocupaciones sobre el reordenamiento de C+
7. Se favorece el alqueno más sustituido, ya que los alquenos más sustituidos son relativamente menores en energía.
8.
Esta reacción se conoce como el reordenamiento del Pinacol.

Observe cómo el carbocatión después del reordenamiento es estabilizado por resonancia por el oxígeno
9. Nota: Si bien el mecanismo es instructivo para la primera parte de la presente respuesta. El reordenamiento de los carbocationes ocurriría y determinaría los productos mayores y menores como se explica en la segunda parte de esta respuesta.

El producto principal de este mecanismo sería el alqueno más altamente sustituido, o el producto formado a partir de las flechas rojas.
Nota: Con el carbocatión secundario adyacente a un centro de carbono terciario, se produciría un desplazamiento de 1,2 hidruro (reordenamiento) para formar un carbocatión terciario y el vcompuesto a continuación sería el producto principal. Siendo el producto menor el mismo producto que el formado a partir de las flechas rojas.

Colaboradores y Atribuciones
- Jeffrey Ma

