14.5: Estados de oxidación de alcoholes y grupos funcionales relacionados
- Page ID
- 76346
Introducción
Indudablemente ya estás familiarizado con la idea general de oxidación y reducción: aprendiste en química general que cuando se oxida un compuesto o átomo pierde electrones, y cuando se reduce gana electrones. También sabes que las reacciones de oxidación y reducción ocurren en pares: si una especie se oxida, otra debe reducirse al mismo tiempo, de ahí el término 'reacción redox”.
La mayoría de las reacciones redox que has visto anteriormente en química general probablemente involucraron el flujo de electrones de un metal a otro, como la reacción entre el ion cobre en solución y el zinc metálico:
\[Cu^{+2}_{(aq)} + Zn_{(s)} \rightarrow Cu_{(s)} + Zn^{+2}_{(aq)} \tag{16.1.1}\]
En química orgánica, las reacciones redox se ven un poco diferentes. Los electrones en una reacción redox orgánica a menudo se transfieren en forma de un ion hidruro: un protón y dos electrones. Debido a que ocurren junto con la transferencia de un protón, estas se denominan comúnmente reacciones de hidrogenación y deshidrogenación: un hidruro más un protón se suma a una molécula de hidrógeno (H 2). Tenga cuidado -no confunda los términos hidrogenación y deshidrogenación con hidratación y deshidratación - estos últimos se refieren a la ganancia y pérdida de una molécula de agua (y no son reacciones redox), mientras que los primeros se refieren a la ganancia y pérdida de una molécula de hidrógeno.
Oxidación y Reducción - The Organic Chemistry View
Cuando un átomo de carbono en un compuesto orgánico pierde un enlace al hidrógeno y gana un nuevo enlace a un heteroátomo (o a otro carbono), decimos que el compuesto ha sido deshidrogenado, u oxidado. Un ejemplo bioquímico muy común es la oxidación de un alcohol a una cetona o aldehído:
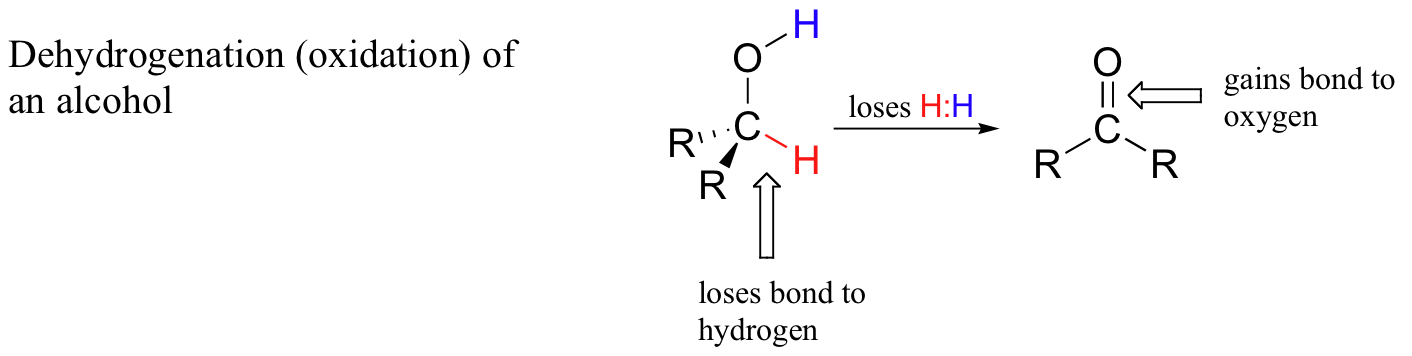
Cuando un átomo de carbono pierde un enlace con hidrógeno y gana un enlace a un heteroátomo (o a otro átomo de carbono), se considera un proceso oxidativo porque el hidrógeno, de todos los elementos, es el menos electronegativo. Así, en el proceso de deshidrogenación el átomo de carbono sufre una pérdida global de densidad electrónica - y la pérdida de electrones es oxidación.
Por el contrario, cuando un átomo de carbono en un compuesto orgánico gana un enlace al hidrógeno y pierde un enlace a un heteroátomo (o a otro átomo de carbono), decimos que el compuesto ha sido hidrogenado, o reducido. La hidrogenación de una cetona a un alcohol, por ejemplo, es en general la inversa de la deshidrogenación de alcohol mostrada anteriormente. A continuación se ilustra otra posibilidad común, la hidrogenación (reducción) de un alqueno a un alcano.
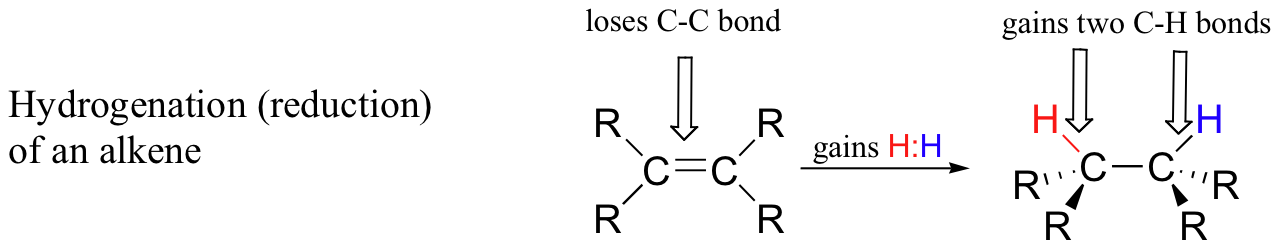
La hidrogenación da como resultado una mayor densidad de electrones en uno o más átomos de carbono, por lo que consideramos que el proceso es uno de reducción de la molécula orgánica.
Observe que ni la hidrogenación ni la deshidrogenación implican la ganancia o pérdida de un átomo de oxígeno. Las reacciones que implican ganancia o pérdida de uno o más átomos de oxígeno generalmente se denominan reacciones de 'oxigenasa' y 'reductasa'.
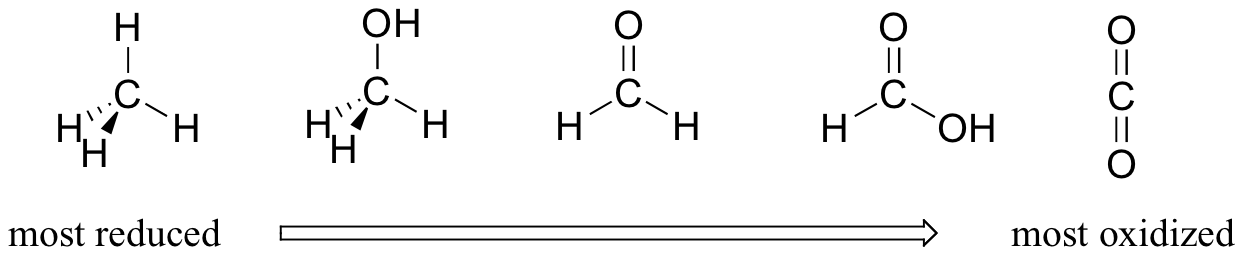
En su mayor parte, al hablar de reacciones redox en química orgánica nos encontramos ante un pequeño conjunto de transformaciones de grupos funcionales muy reconocibles. Por lo tanto, vale la pena familiarizarse con la idea de “estados de oxidación” tal como se aplica a los grupos funcionales orgánicos. Al comparar el número relativo de enlaces con los átomos de hidrógeno, podemos ordenar los grupos funcionales familiares según el estado de oxidación. Tomaremos como ejemplo una serie de compuestos de carbono único. El metano, con cuatro enlaces carbono-hidrógeno, es altamente reducido. El siguiente en la serie está el metanol (un enlace carbono-hidrógeno menos, un enlace carbono-oxígeno más), seguido de formaldehído, formiato y finalmente dióxido de carbono en el extremo altamente oxidado del grupo.
Este patrón es válido para los grupos funcionales relevantes en moléculas orgánicas con dos o más átomos de carbono:
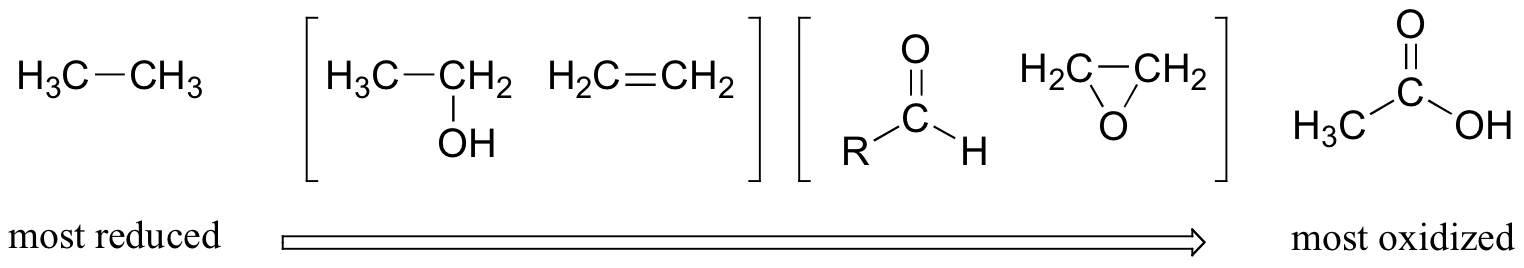
Los alcanos están muy reducidos, mientras que los alcoholes -así como los alquenos, éteres, aminas, sulfuros y ésteres de fosfato- están un paso arriba en la escala de oxidación, seguidos de aldehídos/cetones/iminas y epóxidos, y finalmente por derivados de ácido carboxílico (el dióxido de carbono, en la parte superior de la lista de oxidación, es específico para la serie de carbono simple).
Observe que en la serie de compuestos de dos carbonos anteriores, el etanol y el eteno se consideran en el mismo estado de oxidación. Ya sabes que los alcoholes y alquenos se interconvierten por medio de adición o eliminación de agua. Cuando un alcohol se deshidrata para formar un alqueno, uno de los dos carbonos pierde un enlace C-H y gana un enlace C-C, y así se oxida. Sin embargo, el otro carbono pierde un enlace C-O y gana un enlace C-C, por lo que se considera reducido. En general, por lo tanto, no hay cambio en el estado de oxidación de la molécula.
Se debe aprender a reconocer cuando una reacción implica un cambio en el estado de oxidación en un reactivo orgánico. Al observar la siguiente transformación, por ejemplo, deberías poder reconocer rápidamente que se trata de una oxidación: un grupo funcional alcohol se convierte en una cetona, que es un paso adelante en la escalera de oxidación.
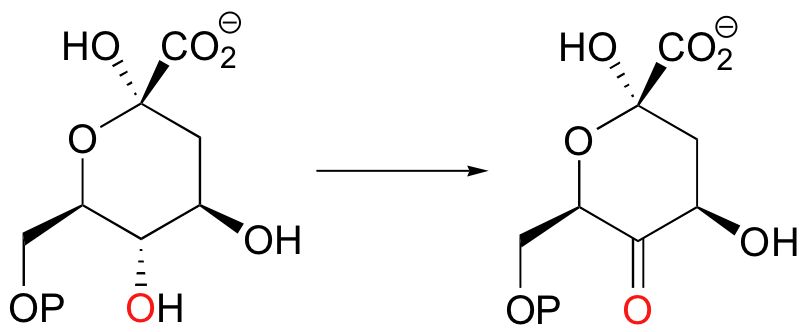
De igual manera, esta siguiente reacción implica la transformación de un derivado de ácido carboxílico (un tioéster) primero en un aldehído, luego en un alcohol: esta es una doble reducción, ya que el sustrato pierde dos enlaces a heteroátomos y gana dos enlaces a hidrógenos.

Una reacción de transferencia de acilo (por ejemplo, la conversión de un fosfato de acilo en una amida) no se considera una reacción redox - el estado de oxidación de la molécula orgánica no cambia a medida que el sustrato se convierte en producto, porque un enlace a un heteroátomo (oxígeno) simplemente se ha comercializado por un enlace a otro heteroátomo (nitrógeno).
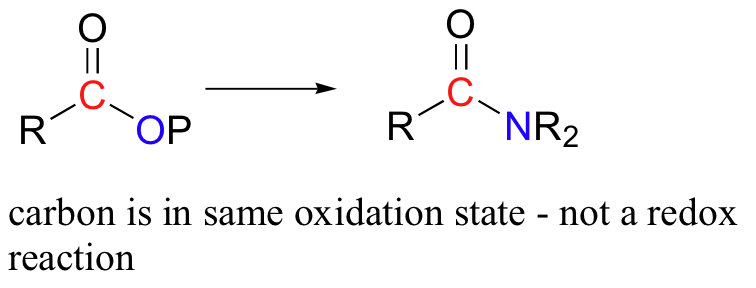
Es importante poder reconocer cuando una molécula orgánica está siendo oxidada o reducida, porque esta información te indica que busques la participación de un agente redox correspondiente que se está reduciendo u oxidado- recuerda, ¡la oxidación y la reducción siempre ocurren en tándem! Pronto conoceremos en detalle los agentes bioquímicos y redox de laboratorio más importantes.
Ejercicios
10. Indicar si las siguientes reacciones son oxidaciones [O], reducciones [H], hidrataciones o deshidrataciones.
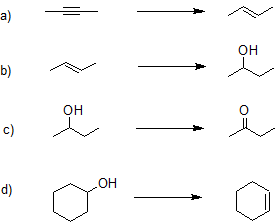
- Responder
-
10.
a) reducción
b) hidratación
c) oxidación
d) deshidratación

