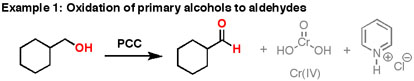
14.6: Reacciones de oxidación de alcoholes
- Page ID
- 76340
Agentes oxidantes
El agente oxidante comúnmente mostrado es una solución de dicromato de sodio o potasio (VI) acidificado con ácido sulfúrico diluido. Si se produce oxidación, la solución naranja que contiene los iones dicromato (VI) se reduce a una solución verde que contiene iones cromo (III). La media ecuación de electrones para esta reacción es
\[ Cr_2O_7^{2-} + 14H^+ + 6e^- \rightarrow 2Cr^{3+} + 7H_2O \tag{17.7.1}\]
- K 2 C r 2O 7 dicromato de potasio
- CrO 3 Trióxido de Cromo
- El clorocromato de piridinio (PCC) es una versión más suave del ácido crómico que es adecuada para convertir un alcohol primario en un aldehído sin oxidarlo hasta convertirlo en un ácido carboxílico. Este reactivo está siendo reemplazado en laboratorios por el peryodinano de Dess‑Martin (DMP), el cual tiene varias ventajas prácticas sobre el PCC, como producir mayores rendimientos y requerir condiciones de reacción menos rigurosas. DMP lleva el nombre de Daniel Dess y James Martin, quienes lo desarrollaron en 1983. Ambos reactivos se utilizan junto con H 2 SO 4, H 2 O
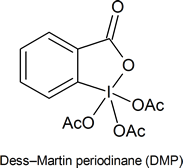
Alcoholes primarios
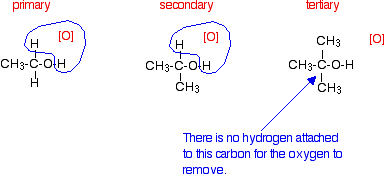
Los alcoholes primarios pueden oxidarse a aldehídos o ácidos carboxílicos dependiendo de las condiciones de reacción. En el caso de la formación de ácidos carboxílicos, el alcohol se oxida primero a un aldehído que luego se oxida más al ácido.
Oxidación completa a ácidos carboxílicos
Es necesario usar un exceso del agente oxidante y asegurarse de que el aldehído formado como el producto a mitad de camino permanezca en la mezcla. El alcohol se calienta a reflujo con un exceso del agente oxidante. Cuando se completa la reacción, el ácido carboxílico se separa por destilación. La ecuación completa para la oxidación del etanol a ácido etanoico es:
\[ 3CH_3CH_2OH + 2Cr_2O_7^{2-} + 16H+ \rightarrow 3CH_3COOH + 4Cr^{3+} + 11H_2O \tag{17.7.1}\]
La versión simplificada más habitual se ve así:
\[ CH_3CH_2OH + 2[O] \rightarrow CH_3COOH + H_2O \tag{17.7.2}\]
Alternativamente, podría escribir ecuaciones separadas para las dos etapas de la reacción: la formación de etanal y luego su posterior oxidación.
\[ CH_3CH_2OH + [O] \rightarrow CH_3CHO + H_2O \tag{17.7.3}\]
\[ CH_3CHO + [O] \rightarrow CH_3COOH \tag{17.7.4}\]
Esto es lo que está sucediendo en la segunda etapa:

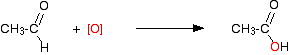
Oxidación parcial a ácidos carboxílicos

Alcoholes secundarios
Los alcoholes secundarios se oxidan a cetonas -y eso es todo. Por ejemplo, si calientas el alcohol secundario propan-2-ol con solución de dicromato de sodio o potasio (VI) acidificada con ácido sulfúrico diluido, obtienes la propanona formada. Jugar con las condiciones de reacción no hace ninguna diferencia en el producto. Usando la versión simple de la ecuación y mostrando la relación entre las estructuras:


Si miras hacia atrás en la segunda etapa de la reacción del alcohol primario, verás que un oxígeno “encajó” entre el carbono y el hidrógeno en el grupo aldehído para producir el ácido carboxílico. En este caso, no existe tal hidrógeno -y la reacción no tiene a dónde ir más allá.
Alcoholes terciarios
Los alcoholes terciarios no se oxidan por solución acidificada de dicromato de sodio o potasio (VI); no hay reacción alguna. Si miras lo que está sucediendo con los alcoholes primarios y secundarios, verás que el agente oxidante está eliminando el hidrógeno del grupo -OH, y un hidrógeno del átomo de carbono unido al -OH. Los alcoholes terciarios no tienen un átomo de hidrógeno unido a ese carbono.
Es necesario poder eliminar esos dos átomos de hidrógeno en particular para establecer el doble enlace carbono-oxígeno.
Oxidación de Alcoholes Primarios por PCC - una mirada más cercana
El clorocromato de piridinio (PCC) es una versión más suave del ácido crómico. 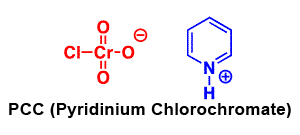
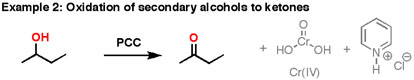
El PCC oxida alcoholes un peldaño en la escalera de oxidación, de alcoholes primarios a aldehídos y de alcoholes secundarios a cetonas. A diferencia del ácido crómico, el PCC no oxidará los aldehídos a ácidos carboxílicos. Similar o lo mismo que:\(CrO_3\) y la piridina (el reactivo de Collins) también oxidará los alcoholes primarios a aldehídos. Aquí hay dos ejemplos de PCC en acción.
- Si agrega un equivalente de PCC a cualquiera de estos alcoholes, obtiene la versión oxidada. Los subproductos (presentados en gris) son Cr (IV) así como clorhidrato de piridinio.
- Hay que tener cuidado con la cantidad de agua presente en la reacción. Si el agua estuviera presente, se puede agregar al aldehído para hacer el hidrato, el cual podría ser oxidado adicionalmente por un segundo equivalente de PCC si estuviera presente. Esto no es una preocupación con las cetonas, ya que no hay H directamente unido a C.
¿Cómo funciona? Las reacciones de oxidación de este tipo son en realidad una especie de reacción de eliminación. Vamos de un enlace simple carbono-oxígeno a un doble enlace carbono-oxígeno. La reacción de eliminación puede ocurrir porque estamos poniendo un buen grupo de salida en el oxígeno, es decir, el cromo, que se desplazará cuando el enlace C-H vecino se rompa con una base.
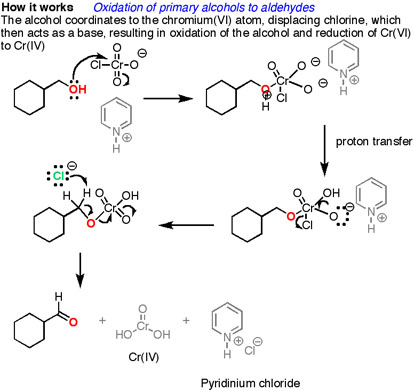
En la primera etapa, el oxígeno en el cromo reacciona con el grupo hidroxi del alcohol para formar el enlace Cr-O. En segundo lugar, un protón sobre el OH (ahora positivo) se transfiere a uno de los oxígenos del cromo, posiblemente a través de la intermediación de la sal de piridinio. Luego se desplaza un ion cloruro, en una reacción que recuerda a una reacción de eliminación 1,2, para formar lo que se conoce como éster de cromato.
El doble enlace C-O se forma cuando una base elimina el protón en el carbono adyacente al oxígeno. [aparte: He dibujado la base como Cl - aunque ciertamente hay otras especies que también podrían actuar como bases aquí (como un alcohol). También es posible que la piridina sea utilizada como base aquí, aunque solo estarán presentes concentraciones muy bajas de la forma desprotonada bajo estas condiciones ácidas.] Los electrones del enlace C-H se mueven para formar el enlace C-O, y en el proceso rompen el enlace O-Cr, y Cr (VI) se convierte en Cr (IV) en el proceso (dibujado aquí como O=Cr (OH) 2).
Notas de la vida real: Si terminas usando PCC en el laboratorio, no olvides agregar tamices moleculares o Celita o algún otro sólido al fondo del matraz, porque de lo contrario obtienes un alquitrán marrón desagradable que es un verdadero dolor importante para limpiar. La toxicidad y el desorden asociados con el cromo han estimulado el desarrollo de otras alternativas como TPAP, IBX, DMP y una serie de otros reactivos limpios que generalmente no aprendes hasta la escuela de posgrado.
Ejemplos
Ejercicios
11. Dibuja el alcohol del que habrían resultado las siguientes cetonas/aldehídos si se hubieran oxidado. ¿Qué oxidante se podría usar?
a ) b
) b
12. Mostrar los productos de la oxidación de 1-propanol y 2-propanol con ácido crómico en solución acuosa.
- Contestar
-
11. Cualquier oxidante capaz de oxidar un alcohol a una cetona funcionaría, como el reactivo Jones (CrO 3, H 2 SO 4, H 2 O), PCC o periodinano de Dess-Martin.
(a)

(b) Dado que se trata de un alcohol primario, existen algunas precauciones necesarias para evitar la formación del ácido carboxílico. Oxidantes más suaves como el peryodinano de Dess-Martin, y también PCC (no hay agua para formar el ácido carboxílico) funcionarían.

12. Las respuestas se correlacionan con la pregunta.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Jim Clark (Chemguide.co.uk)
- James Ashenhurst (MasterOrganicChemistry.com)