16.1: Estabilidad de Dienos Conjugados - Teoría Orbital Molecular
- Page ID
- 76037
Introducción
Los dienos conjugados se caracterizan por alternar dobles enlaces carbono-carbono separados por enlaces simples carbono-carbono. Los dienos acumulados se caracterizan por dobles enlaces carbono-carbono adyacentes. Mientras que los dienos conjugados son energéticamente más estables que los dobles enlaces aislados. Los dobles enlaces acumulados son inestables. La química de los dobles enlaces acumulados se puede explorar con anticipación en cursos de química orgánica. La química de los alquenos aislados está cubierta en los Capítulos 8 y 9 de este libreTexto. La química de los dobles enlaces conjugados es el foco de este capítulo.
Estabilidad de dieno conjugado
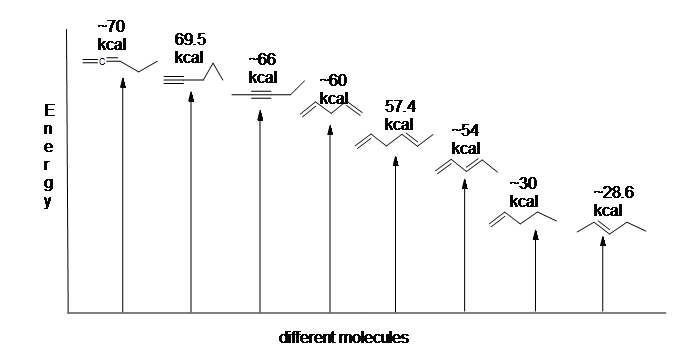
Los dienos conjugados son más estables que los no conjugados (tanto aislados como acumulados) debido a factores como la deslocalización de la carga a través de resonancia y energía de hibridación. Esta estabilidad se puede observar en las diferencias en las energías de hidrogenación entre alquenos aislados y conjugados. Dado que cuanto mayor es el calor de hidrogenación, menos estable es el compuesto, se muestra a continuación que los dienos conjugados (~54 kcal) tienen un menor calor de hidrogenación que sus homólogos aislados (~60 kcal) y dienos acumulados (~70 kcal).
Aquí hay un diagrama de energía que compara diferentes tipos de enlaces con sus calores de hidrogenación para mostrar la estabilidad relativa de cada molécula:
Estabilidad de dienos conjugados - La explicación de la resonancia
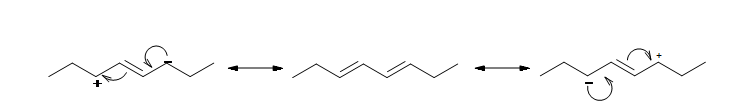
Los dobles enlaces conjugados están separados por un enlace sencillo. Los 1,3-dienos son un excelente ejemplo de un sistema conjugado. Cada carbono en 1,3 dienos es sp 2 hibridado y por lo tanto tiene una p orbital. Los cuatro orbitales p en 1,3-butadieno se superponen para formar un sistema conjugado.
La estructura de resonancia que se muestra a continuación da una buena comprensión de cómo los electrones pi se deslocalizan a través de los cuatro carbonos en este dieno conjugado. Esta deslocalización de electrones estabiliza el dieno conjugado:
Estabilidad de dienos conjugados - Explicación de los orbitales moleculares
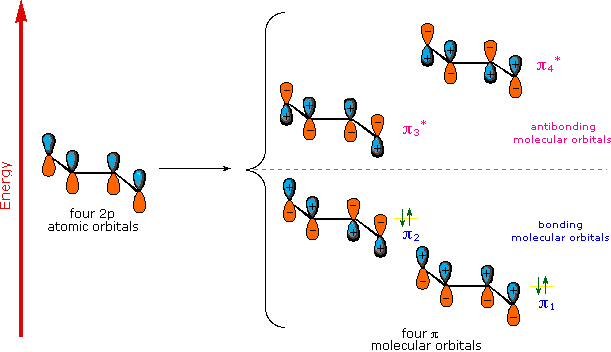
A continuación se muestra un modelo orbital molecular para 1,3-butadieno. Tenga en cuenta que los lóbulos de los cuatro componentes orbitales p en cada orbital pi están coloreados de manera diferente y llevan un signo más o menos. Esta distinción se refiere a diferentes fases, definidas por las ecuaciones matemáticas de onda para tales orbitales. Las regiones en las que los lóbulos orbitales adyacentes experimentan un cambio de fase se denominan nodos. La densidad de electrones orbitales es cero en tales regiones. Así, un único orbital p tiene un nodo en el núcleo, y todos los orbitales pi mostrados aquí tienen un plano nodal que está definido por los átomos del dieno. Esta es la única superficie nodal en el pi-orbital de menor energía, π 1. Los orbitales pi-orbitales de mayor energía tienen un número creciente de nodos. Ya que el 1,3-butadieno tiene cuatro electrones pi. Los dos orbitales moleculares de unión se rellenan para explicar la estabilidad medible de los dobles enlaces conjugados.
Ejercicio
1. El calor de hidrogenación para el aleno es de aproximadamente 300 kJ/mol. Ordene un dieno conjugado, un dieno no conjugado y un aleno para aumentar la estabilidad.

- Contestar
-
1. aleno < dieno no conjugado < dieno conjugado (más estable)
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)

