16.2: Cationes alílicos
- Page ID
- 76064
Resonancia y estabilidad de carbocationes alílicos
La conjugación ocurre cuando p orbital en tres o más átomos adyacentes puede solaparse. La conjugación tiende a estabilizar las moléculas. Los carbocationes alílicos son un sistema conjugado común. Las estructuras de resonancia a continuación ayudan a explicar la estabilidad de los carbocationes alílicos. La verdadera estructura del carbocatión alílico conjugado es un híbrido de las dos estructuras de resonancia, por lo que la carga positiva se deslocaliza sobre los dos carbonos terminales. Esta deslocalización estabiliza el carbocatión alílico haciéndolo más estable que un carbocatión primario normal.
La carga positiva de un carbocatión está contenida en un orbital p de un carbono hibridado sp 2. Esto permite la superposición con dobles enlaces. La carga positiva es más estable porque se extiende sobre 2 carbonos.
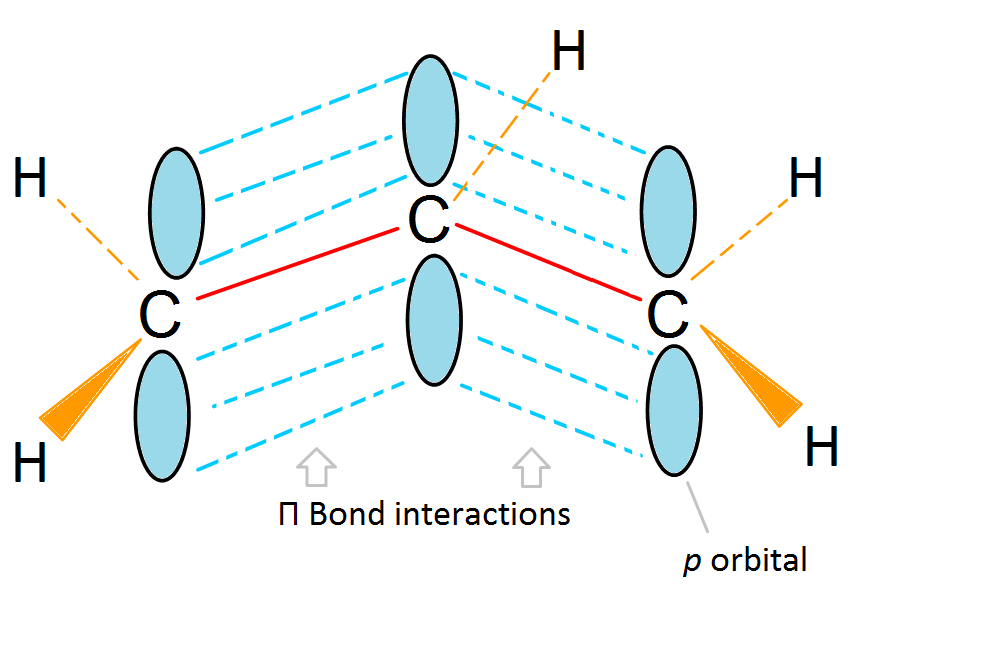
Orbitales moleculares y estabilidad de carbocationes alílicos
La estabilidad del carbocatión del propeno se debe a un sistema de electrones π conjugados. Un “doble vínculo” realmente no existe. En cambio, se trata de un grupo de 3 orbitales p adyacentes, superpuestos y no hibridados que llamamos sistema de electrones π conjugados. Se pueden ver claramente las interacciones entre los tres orbitales p de los tres carbonos dando como resultado un catión realmente estable. Todo se reduce a donde está la ubicación del carbono deficiente en electrones.
Las descripciones orbitales moleculares pueden explicar la estabilidad alílica de otra manera usando 2-propenilo. Fig.6
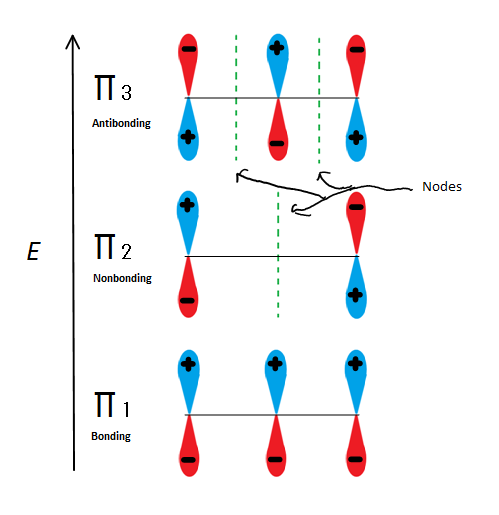
Si solo tomamos el orbital molecular π y no ninguno de los s, obtenemos tres de ellos. π 1 está uniendo sin nodos, π 2 es no-bonding (En otras palabras, la misma energía que un p-orbital regular) con un nodo, y π 3 es antibonding con 2 nodos (ninguno de los orbitales está interactuando). Los dos primeros electrones entrarán en el orbital molecular π 1, independientemente de si es un catión, un radical o un anión. Si se trata de un radical o anión, el siguiente electrón entra en el orbital molecular π 2. El último electrón anión entra también en el orbital no enlazante. Entonces, no importa qué tipo de centro de carbono exista, ningún electrón entrará jamás en el orbital antienlace.
Los orbitales Bonding son los orbitales de menor energía y son favorables, razón por la cual se llenan primero. A pesar de que los orbitales no ligantes pueden llenarse, la energía general del sistema es aún menor y más estable debido a los orbitales moleculares de unión llenos.
Esta figura también muestra que π 2 es el único orbital molecular donde difiere el electrión, y también es donde un solo nodo pasa por el medio. Debido a esto, las cargas de la molécula se encuentran principalmente en los dos carbonos terminales y no en el carbono medio.
Esta descripción orbital molecular también puede ilustrar la estabilidad de los centros de carbono alílicos en la figura 7.
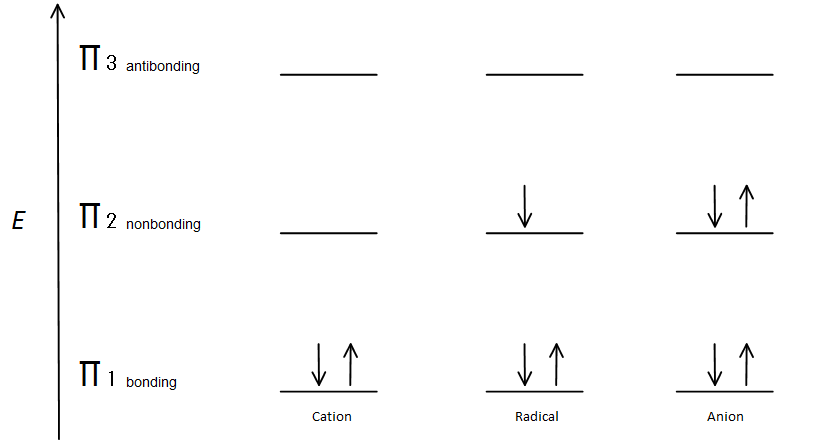
El orbital de unión π es menor en energía que el orbital p no enlazante. Dado que cada centro de carbono mostrado tiene dos electrones en la energía más baja, uniendo orbitales π, la energía de cada sistema se reduce en general (y por lo tanto más estable), independientemente del catión, radical o anión.
Estabilidades Relativas de Carbocationes
Radicales alílicos
Como químicos orgánicos, estamos particularmente interesados en los intermedios radicales en los que el electrón desapareado reside en un átomo de carbono. La evidencia experimental indica que los tres enlaces en un radical de carbono tienen geometría plana trigonal, por lo que se considera que el carbono está hibridado sp 2 con el electrón desapareado que ocupa el orbital 2p z perpendicular, no hibridado. Contraste esta imagen con intermedios de carbocationes y carbaniones, que son ambos también planos trigonales pero cuyos orbitales 2p z contienen cero o dos electrones, respectivamente.

La tendencia en la estabilidad de los radicales de carbono es paralela a la de los carbocationes (sección 8.4B): los radicales terciarios, por ejemplo, son más estables que los radicales secundarios, seguidos de los radicales primarios y metilo. Esto debería tener sentido intuitivo, porque los radicales, como los carbocationes, pueden considerarse deficientes en electrones, y así se estabilizan por los efectos donadores de electrones de los grupos alquilo cercanos. Los radicales bencílicos y alílicos son más estables que los radicales alquilo debido a los efectos de resonancia; un electrón desapareado puede deslocalizarse sobre un sistema de enlaces pi conjugados. Un radical alílico, por ejemplo, se puede representar como un sistema de tres orbitales paralelos 2p z que comparten tres electrones.
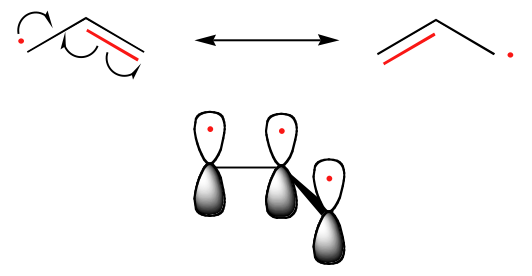
Esto también puede explicar por qué los radicales alílicos son mucho más estables que los carbocationes secundarios o incluso terciarios. Todo esto se debe al posicionamiento de los orbitales pi y a la capacidad de superposición para fortalecer el enlace sencillo entre los dos dobles enlaces.
Ejercicio
2. Dibuje la estructura de la línea de enlace para el carbocatión más estable que se pueda formar a partir de cada hidrocarburo a continuación. Organizar los carbocationes en orden de estabilidad decreciente.
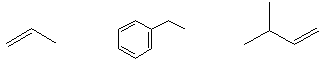
- Contestar
-
2. Carbocationes en orden de estabilidad decreciente.
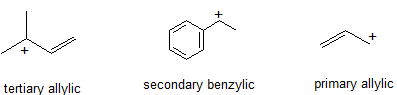
Colaboradores y Atribuciones
Prof. Steven Farmer (Sonoma State University)
Jim Clark (Chemguide.co.uk)
- Jeffrey Hu
![]()

