16.7: Estereoquímica de Diels-Alder
- Page ID
- 76054
Las reacciones de Diels-Alder son estereoespecíficas
La reacción de Diels-Alder es enormemente útil para los químicos orgánicos sintéticos, no solo porque las reacciones formadoras de anillos son útiles en general sino también porque en muchos casos se forman dos nuevos estereocentros, y la reacción es inherentemente estereoespecífica. Un dienófilo cis generará un anillo con sustitución cis, mientras que un dienófilo trans generará un anillo con sustitución trans:
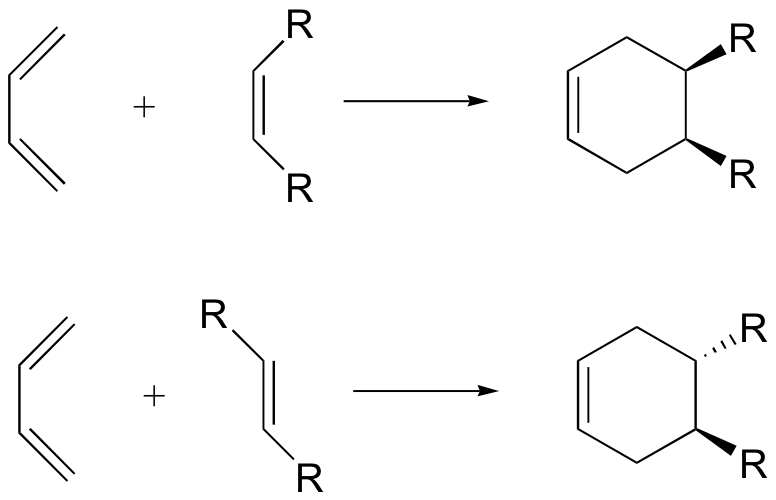
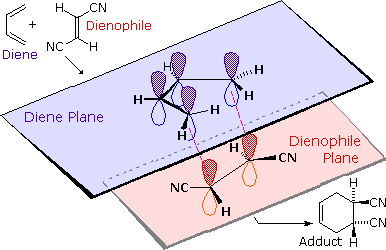
Señalamos anteriormente que las reacciones de adición de alquenos a menudo exhibían estereoselectividad, en que los elementos reactivos en algunos casos agregaban syn y en otros casos anti al plano del doble enlace. Ambos reactivos en la reacción de Diels-Alder pueden demostrar estereoisomería, y cuando lo hacen se encuentra que las configuraciones relativas de los reactivos se conservan en el producto (el aducto). El siguiente dibujo ilustra este hecho para la reacción del 1,3-butadieno con (E) -dicianoeteno. La relación trans de los grupos ciano en el dienófilo se conserva en el anillo de seis miembros del aducto. Asimismo, si los carbonos terminales del dieno llevan sustituyentes, su configuración relativa quedará retenida en el aducto. Usando la terminología anterior, podríamos decir que el vínculo tanto con el dieno como con el dienófilo es syn. Una descripción alternativa, sin embargo, se refiere a la naturaleza plana de ambos reactivos y a los términos la unión en cada caso para ser suprafacial (es decir, hacia o desde la misma cara de cada plano). Esta estereoespecificidad también confirma la naturaleza sincrónica del enlace 1,4-que tiene lugar.
Subyuyentes de Dieno y Reactividad de Diels-Aliso
Para que ocurra una reacción de Diels-Alder, la molécula de dieno debe adoptar lo que se denomina conformación s-cis:
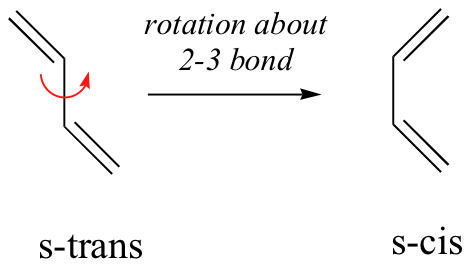
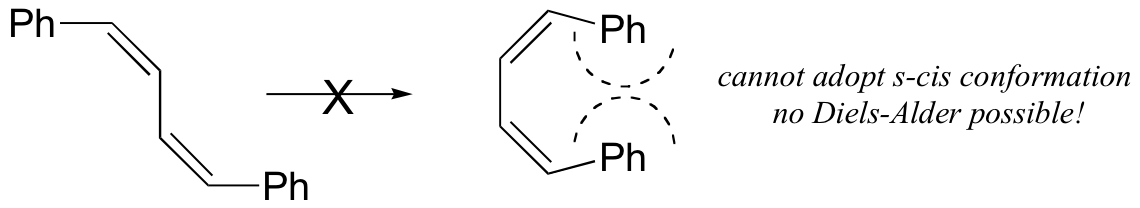
La conformación s-cis es mayor en energía que la conformación s-trans, debido al impedimento estérico. Para algunos dienos, el impedimento estérico extremo hace que la conformación s-cis sea altamente tensa, y por esta razón dichos dienos no experimentan fácilmente reacciones de Diels-Alder.
Formación de anillos bicíclicos y las posiciones exo y endo
Los dienos cíclicos que están 'bloqueados' en la conformación s-cis son especialmente reactivos. El resultado de una reacción de Diels-Alder que involucra un dieno cíclico es una estructura bicíclica:

Aquí vemos otro elemento de estereoespecialidad: las reacciones de Diels-Alder con dienos cíclicos favorecen la formación de estructuras bicíclicas en las que los sustituyentes están en la posición endo.

La posición endo en una estructura bicíclica se refiere a la posición que está dentro de la forma cóncava del anillo más grande (seis miembros). Como podrías predecir, la posición exo se refiere a la posición exterior.
La velocidad a la que se produce una reacción de Diels-Alder depende de factores electrónicos y estéricos. Una reacción particularmente rápida de Diels-Alder tiene lugar entre el ciclopentadieno y el anhídrido maleico.
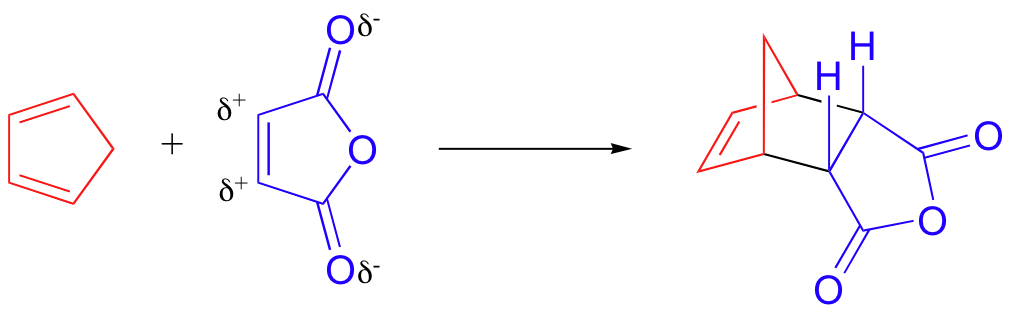
Ya sabemos que el ciclopentadieno es un buen dieno debido a su conformación s-cis inherente. El anhídrido maleico también es un muy buen dienófilo, ya que el efecto aceptor de electrones de los grupos carbonilo hace que los dos carbonos de alqueno sean pobres en electrones, y por lo tanto un buen objetivo para la reacción con los electrones pi en el dieno.
En general, las reacciones de Diels-Alder proceden más rápidamente con grupos donadores de electrones en el dieno (por ejemplo, grupos alquilo) y grupos aceptores de electrones en el dienófilo.
Los alquinos también pueden servir como dienófilos en las reacciones de Diels-Alder:
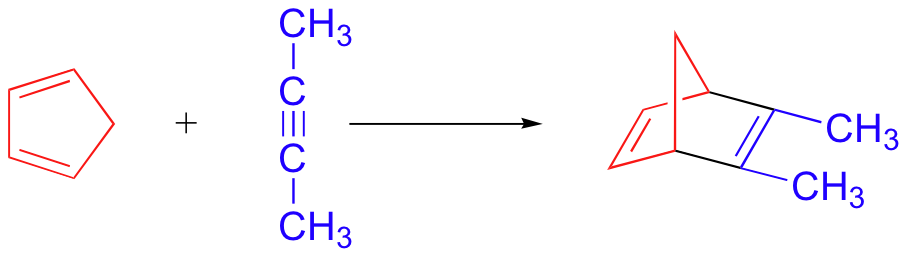
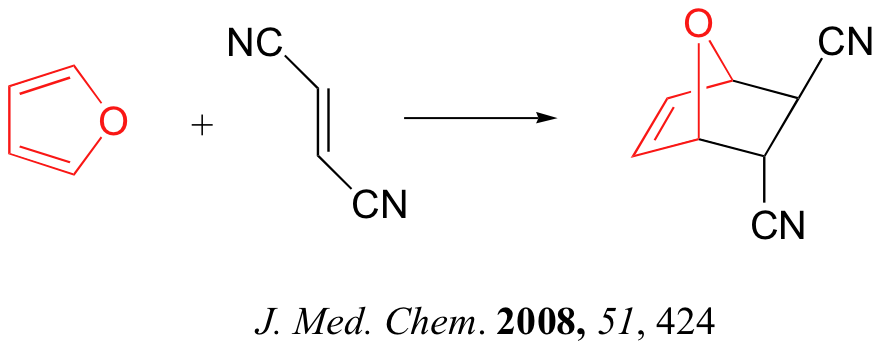
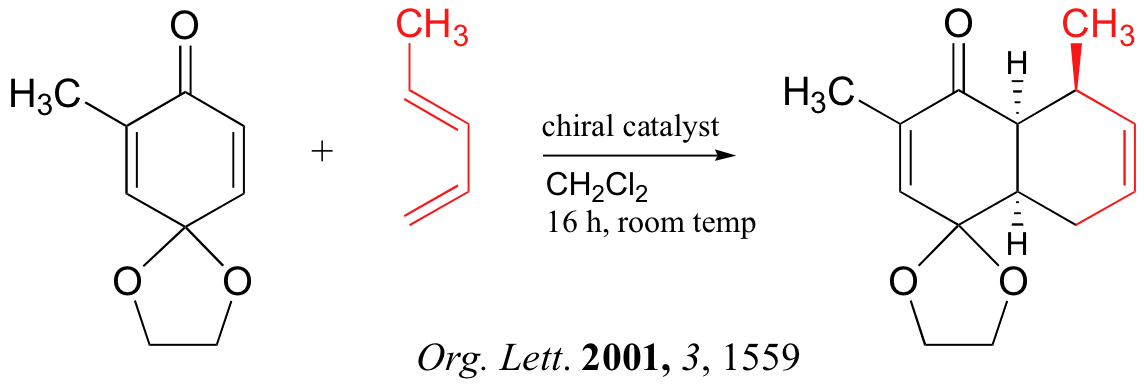
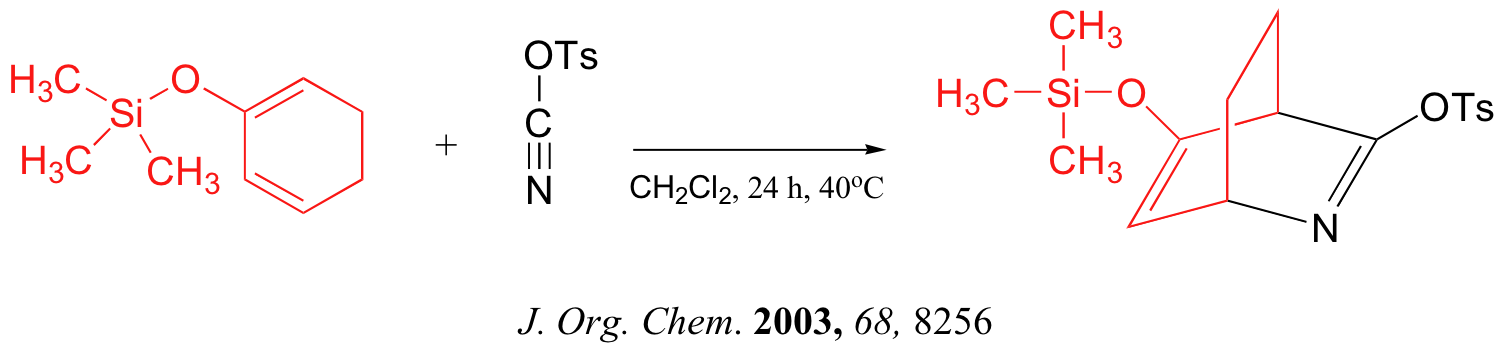
A continuación se presentan tres ejemplos de reacciones de Diels-Alder que se han reportado en los últimos años:
Otras reacciones pericíclicos
La reacción de Diels-Alder es solo un ejemplo de reacción pericíclica: este es un término general que se refiere a reordenamientos concertados que proceden a través de estados cíclicos de transición. Dos reacciones pericíclicas intramoleculares bien estudiadas se conocen como el reordenamiento de Cope.
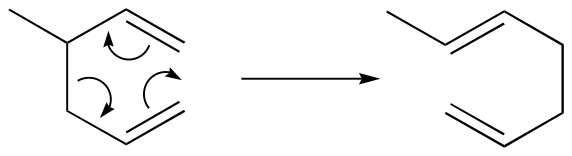
. y el reordenamiento de Claisen (cuando se trata de oxígeno):
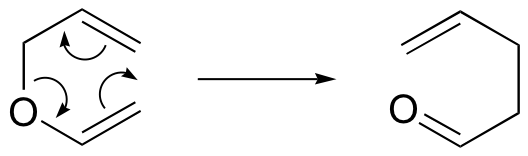
Observe que las dos reacciones requieren compuestos en los que dos dobles enlaces están separados por tres enlaces simples.
Las reacciones pericíclicas son raras en la química biológica, pero aquí hay un ejemplo: el reordenamiento de Claisen catalizado por la mutasa de corismato en la vía biosintética de aminoácidos aromáticos.
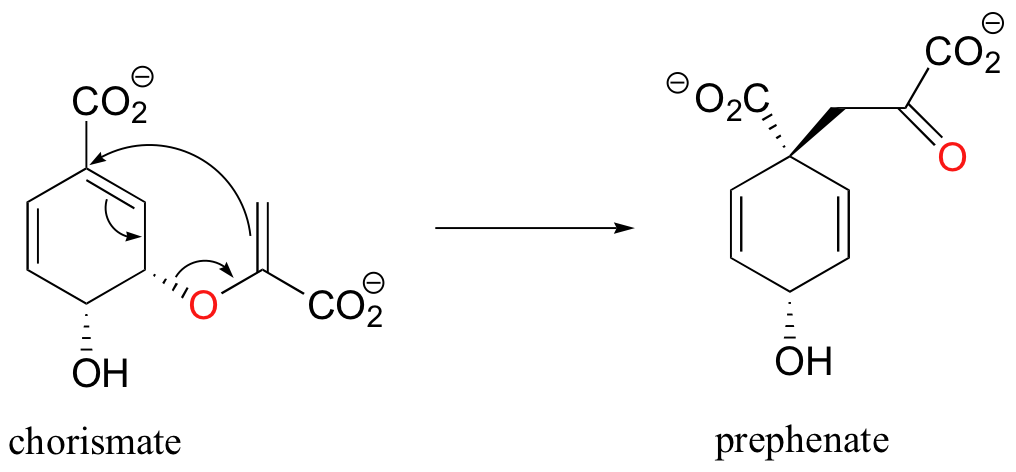
El estudio de las reacciones pericíclicas es un área de química física orgánica que floreció a mediados de la década de 1960, debido principalmente al trabajo de R.B. Woodward, Roald Hoffman y Kenichi Fukui. Las reglas de Woodward-Hoffman para las reacciones pericíclicas (y una versión simplificada introducida por Fukui) utilizan la teoría orbital molecular para explicar por qué ocurren algunos procesos pericíclicos y otros no. Una discusión completa está más allá del alcance de este texto, pero si vas a estudiar química orgánica a nivel avanzado de pregrado o posgrado seguramente te introducirán en esta fascinante área de indagación.
Resumen de la reacción de Diels-Alder
Las características esenciales de la reacción de cicloadición de Diels-Alder pueden resumirse de la siguiente manera:
- La reacción siempre crea un nuevo anillo de seis miembros. Cuando es intramolecular, también se puede formar otro anillo.
- El componente dieno debe ser capaz de asumir una conformación s-cis.
- Los grupos extractores de electrones en el dienófilo facilitan la reacción.
- Los grupos donadores de electrones en el dieno facilitan la reacción.
- El impedimento estérico en los sitios de unión puede inhibir o prevenir la reacción.
- La reacción es estereoespecífica con respecto a la configuración de sustituyentes tanto en el dienófilo como en el dieno.
Estas características se ilustran mediante los siguientes ocho ejemplos, uno de los cuales no da una cicloadición de Diels-Alder.
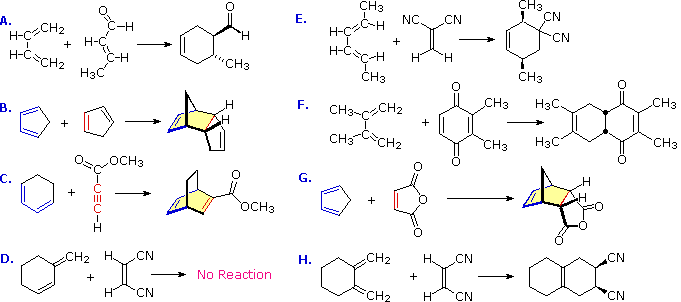
Ejercicio
8. De los siguientes dienos, ¿cuáles son S-trans y cuáles son s-cis? De los que son s-trans, ¿son capaces de rotar para convertirse en s-cis?

9. Predecir el producto de la siguiente reacción.

- Contestar
-
8.
A) s-trans, incapaz de rotar para convertirse en s-cis
B) s-cis
C) s-trans, puede rotar para convertirse en s-cis.
9.
.png)
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)