17.5: Aromaticidad y Regla de Huckel
- Page ID
- 76481
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)En 1931, el químico y físico alemán Erich Hückel propuso una teoría para ayudar a determinar si una molécula de anillo plano tendría propiedades aromáticas. Su regla establece que si una molécula cíclica, plana tiene 4n+2\(π\) electrones, se considera aromática. Esta regla llegaría a conocerse como Regla de Hückel.
Regla de Huckel: Aromático, Antiaromático y No Aromático
La Regla de Huckel es un conjunto de algoritmos que combinan el número de\(\pi\) electrones (\(N\)) y la estructura física del sistema de anillos para determinar si la molécula es aromática, antiaromática o no aromática.
El número de\(\pi\) electrones en un sistema aromático se puede determinar mediante el siguiente algoritmo:
\[N = 4n +2\]
donde\(n\) es un entero.
El número de\(\pi\) electrones en un sistema antiaromático se puede determinar mediante el siguiente algoritmo:
\[N = 4n\]
donde\(n\) es un entero.
Si un compuesto no tiene un anillo continuo de orbitales p conjugados en una conformación plana, entonces es no aromático.
La Regla de Huckel es un primer paso útil para evaluar el potencial de una molécula anillada para ser aromática. El requisito plano del anillo puede requerir más investigación.
Cuatro Criterios de Aromaticidad
Al decidir si un compuesto es aromático, pasar por la siguiente lista de verificación. Si el compuesto no cumple con todos los criterios siguientes, es probable que no sea aromático.
- La molécula es cíclica (un anillo de átomos)
- La molécula es plana (todos los átomos de la molécula se encuentran en el mismo plano)
- La molécula está completamente conjugada (p orbitales en cada átomo del anillo)
- La molécula tiene 4n+2\(π\) electrones (n=0 o cualquier número entero positivo)
¿Por qué 4n+2\(\pi\) Electrones?
Según la Teoría Orbital Molecular de Hückel, un compuesto es particularmente estable si todos sus orbitales moleculares de enlace están llenos de electrones emparejados. Esto es cierto de los compuestos aromáticos, lo que significa que son bastante estables. Con compuestos aromáticos, 2 electrones llenan el orbital molecular de menor energía y 4 electrones llenan cada nivel de energía posterior (el número de niveles de energía posteriores se denota con n), dejando todos los orbitales de enlace llenos y sin orbitales antienlace ocupados. Esto da un total de 4n+2\(\pi\) electrones. Se puede ver cómo funciona esto con el diagrama orbital molecular para el compuesto aromático, benceno, a continuación. El benceno tiene 6\(\pi\) electrones. Sus primeros 2\(\pi\) electrones llenan el orbital de menor energía, y le quedan 4\(\pi\) electrones. Estos 4 llenan los orbitales del siguiente nivel de energía. Observe cómo se llenan todos sus orbitales de unión, pero ninguno de los orbitales antienlace tiene electrones.
.jpg)
Para aplicar la regla 4n+2, primero cuente el número de\(\pi\) electrones en la molécula. Entonces, establezca este número igual a\(4n+2\) y resuelva para\(n\). Si es 0 o cualquier entero positivo (1, 2, 3,...), se ha cumplido la regla. Por ejemplo, el benceno tiene seis\(\pi\) electrones:
\[\begin{align*} 4n + 2 &= 6 \\ 4n &= 4 \\ n &= 1 \end{align*}\]
Para el benceno, encontramos eso\(n=1\), que es un entero positivo, por lo que se cumple la regla.
¿Cómo se puede saber qué electrones son\(\pi\) electrones?
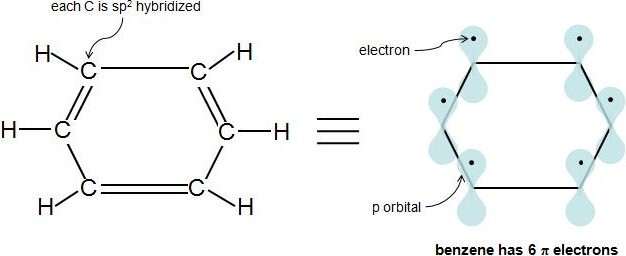
Quizás la parte más dura de la Regla de Hückel es averiguar qué electrones en el compuesto son en realidad\(\pi\) electrones. Una vez resuelto esto, la regla es bastante sencilla. \(\pi\)los electrones se encuentran en orbitales p y los átomos\(sp^2\) hibridados tienen 1 p orbital cada uno. Entonces, si cada átomo de carbono en el compuesto cíclico se\(sp^2\) hibrida, esto significa que la molécula está completamente conjugada (tiene 1 p orbital en cada átomo), y los electrones en estos p orbitales son los\(\pi\) electrones. Una manera sencilla de saber si un átomo está\(sp^2\) hibridado es ver si tiene 3 átomos unidos y no hay pares solitarios de electrones. Este video proporciona un tutorial muy agradable sobre cómo determinar la hibridación de un átomo. En un compuesto hidrocarbonado cíclico con enlaces simples y dobles alternantes, cada carbono está unido a 1 hidrógeno y otros 2 carbonos. Por lo tanto, cada carbono se\(sp^2\) hibrida y tiene un orbital p. Veamos nuestro ejemplo anterior, benceno:
Cada doble enlace (enlace π) siempre aporta 2\(\pi\) electrones. El benceno tiene 3 dobles enlaces, por lo que tiene 6\(\pi\) electrones.
Iones Aromáticos
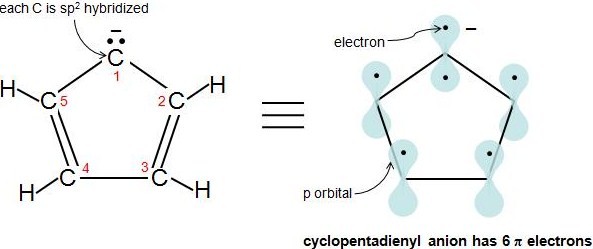
La Regla de Hückel también se aplica a los iones. Siempre y cuando un compuesto tenga 4n+2\(\pi\) electrones, no importa si la molécula es neutra o tiene carga. Por ejemplo, el anión ciclopentadienilo es un ion aromático. ¿Cómo sabemos que está totalmente conjugado? Es decir, ¿cómo sabemos que cada átomo en esta molécula tiene 1 p orbital? Veamos la siguiente figura. Los carbonos 2-5 son sp 2 hibridados porque tienen 3 átomos unidos y no tienen pares de electrones solitarios. ¿Qué pasa con el carbono 1? Otra regla simple para determinar si un átomo es sp 2 hibridado es si un átomo tiene 1 o más pares solitarios y está unido a un átomo hibridado sp 2, entonces ese átomo es sp 2 hibridado también. Este video explica muy claramente la regla. Por lo tanto, el carbono 1 tiene una órbita p. El anión ciclopentadienilo tiene 6\(\pi\) electrones y cumple con la regla 4n+2.
Compuestos aromáticos heterocíclicos
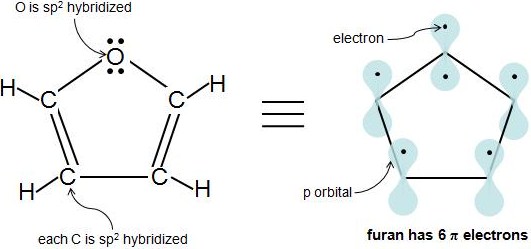
Hasta el momento, se han encontrado muchos anillos homocíclicos de carbono, pero los compuestos con elementos distintos al carbono en el anillo también pueden ser aromáticos, siempre y cuando cumplan con los criterios de aromaticidad. Estas moléculas se denominan compuestos heterocíclicos porque contienen 1 o más átomos diferentes distintos del carbono en el anillo. Un ejemplo común es el furano, que contiene un átomo de oxígeno. Sabemos que todos los carbonos en furano están hibridados sp 2. Pero, ¿se hibrida el átomo de oxígeno sp 2? El oxígeno tiene al menos 1 par de electrones solitarios y está unido a un átomo hibridado sp 2, por lo que también se hibrida sp 2. Observe cómo el oxígeno tiene 2 pares solitarios de electrones. ¿Cuántos de esos electrones son\(\pi\) electrones? Un átomo hibridado sp 2 solo tiene 1 p orbital, que solo puede contener 2 electrones, por lo que sabemos que 1 par de electrones está en el orbital p, mientras que el otro par está en un orbital sp 2. Entonces, solo 1 de los 2 pares de electrones solitarios del oxígeno son\(\pi\) electrones. Furan tiene 6\(\pi\) electrones y cumple con la regla 4n+2.
Un error común
Un concepto erróneo muy común es que la hibridación puede usarse para predecir la geometría, o que la hibridación de alguna manera implica un costo de energía asociado con la 'promoción' de electrones en los orbitales híbridos. Esto es totalmente erróneo. La hibridación siempre está determinada por la geometría. Solo puedes asignar estados de hibridación a un átomo si ya conoces su geometría, con base en alguna evidencia experimental o teórica. La geometría del oxígeno en furano es plana trigonal y por lo tanto la hibridación debe ser\(sp^2\).
La regla específica es que si tienes un sistema\(sp^2\) conjugado, el par solitario estará involucrado si hace que el sistema sea más estable. En este caso, confiriendo\(4n+2\) aromaticidad a Hückel. Para furano con dos pares solitarios en el átomo de oxígeno, si contamos electrones de los átomos de carbono, tenemos 4 (uno por carbono). Por lo que sumar dos electrones de uno de los pares solitarios dará 6 = 4 (1) +2, por lo que la regla de Hückel es aplicable y el furano es aromático.
Ejercicio
3. Utilizando los criterios de aromaticidad, determinar si las siguientes moléculas son aromáticas:
- Contestar
-
3.
Cpd 1: Aromático - solo 1 de los pares solitarios de S cuenta como\(\pi\) electrones, por lo que hay 6\(\pi\) electrones, n=1 No aromático - no completamente conjugado, la C superior es sp 3 hibridada
Cpd 2: No aromático - el C superior es sp 2 hibridado, pero hay 4\(\pi\) electrones, n=1/2
Cpd 3: Aromático - N está usando su orbital 1 p para los electrones en el doble enlace, por lo que su par solitario de\(\pi\) electrones no son electrones, hay 6\(\pi\) electrones, n=1
Cpd 4: Aromático - hay 6\(\pi\) electrones, n=1
Cpd 5: Aromático - hay 6\(\pi\) electrones, n=1 porque el N asume hibridación sp 2.
Cpd 6: No aromático - todos los átomos son sp 2 hibridados, pero solo 1 de los pares solitarios de S cuenta como\(\pi\) electrones, por lo que hay 8\(\pi\) electrones, n=1.5
Cpd 7: No aromático - hay 4\(\pi\) electrones, n=1/2
Cpd 8: Aromático - solo 1 de los pares solitarios de N cuenta como\(\pi\) electrones, por lo que hay 6\(\pi\) electrones, n=1
Cpd 9: No aromático - no completamente conjugado, la C superior es sp 3 hibridada
Cpd 10: Aromático - O está usando su orbital 1 p para las elecciones en el doble enlace, por lo que su par solitario de\(\pi\) electrones no son electrones, hay 6\(\pi\) electrones, n=1
Referencias
- Vollhardt, Peter y Neil E. Schore. Química Orgánica: Estructura y Función. 5ta ed. Nueva York: W. H. Freeman & Company, 2007.
- Berson, Jerónimo. Creatividad Química: Ideas de la Obra de Woodward, Hückel, Meerwein y Otros. Nueva York: Wiley-VCH, 1999.
- Tejón, G.M. Carácter Aromático y Aromaticidad. Londres, Inglaterra: Cambridge University Press, 1969.
- Lewis, David y David Peters. Hechos y Teorías de la Aromaticidad. Londres, Inglaterra: Macmillan Press, 1975.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
- bon and Geoff Hutchison from Chemistry StackExchange


.jpg)
.jpg)
.jpg)
.jpg)