18.6: Efectos de los sustituyentes en la reacción EAS
- Page ID
- 76099
Nota Importante:
Reconocer sustituyentes como Donantes o Retiradores de Electrones es una habilidad útil para evaluar los mecanismos de reacción. Para las reacciones de Sustitución Aromática Electrofílica (EAS), la etapa determinante de la velocidad es la formación de un complejo sigma cargado positivamente. En futuras reacciones, el intermedio puede tener una carga negativa. Si bien las propiedades de donación y extracción de electrones de un sustituyente son inherentes dentro del sustituyente, su efecto sobre la estabilidad de un intermedio y la velocidad de reacción depende de la carga del intermedio.
Los sustituyentes y sus efectos directores en reacciones EAS
Los grupos donadores de electrones (D) dirigen la reacción a la posición orto o para, lo que significa los sustitutos electrófilos del hidrógeno sobre el carbono 2 o el carbono 4 en relación con el grupo donante. El grupo retirante dirige la reacción a la posición meta, lo que significa que los electrófilos sustituyen al hidrógeno sobre el carbono 3 en relación con el grupo retirante. Los halógenos son una excepción a este patrón. Los halógenos son un grupo desactivante que dirige la sustitución orto o para.

Ejemplos de grupos donadores de electrones en el orden relativo desde el grupo más activante hasta el menos activador:
-NH 2, -NR 2 > -OH, -OR> -NHCOR> -CH 3 y otros grupos alquilo con R como grupos alquilo (C n H 2n +1)
Ejemplos de grupos de retirada de electrones en el orden relativo desde los más desactivantes hasta los menos desactivantes:
-NO 2, -CF 3 > -COR, -CN, -CO 2 R, -SO 3 H > Halógenos con R como grupos alquilo (C n H 2n +1)
orto-, Para-directores vía Resonancia
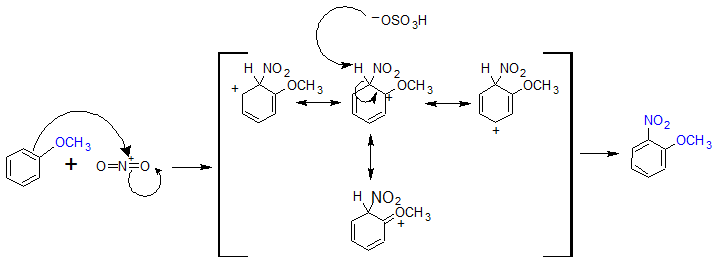
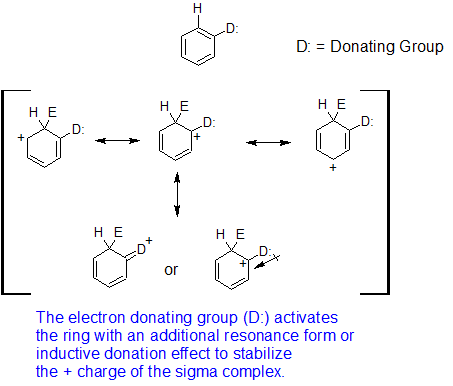
Los grupos que donan electrones a través de resonancia son orto-, para-directores para reacciones EAS. Se utilizará metoxibenceno (anisol) para demostrar la dirección orto, para de los sustituyentes que estabilizan el complejo sigma a través de resonancia. El ion nitronio (O=N + =O) se utilizará para representar el electrófilo (E+).
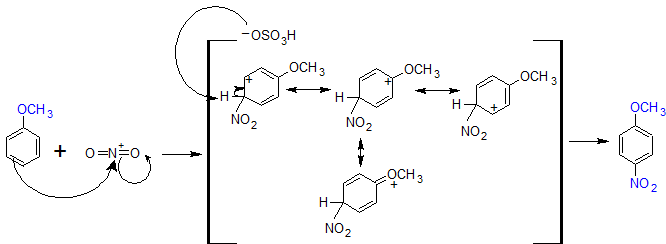
A continuación se muestran los mecanismos orto y para-dirigidos para la nitración del anisol. Cuando el grupo nitro se suma en la posición orto o para, la estabilidad del complejo sigma se incrementa por la presencia de una cuarta forma de resonancia. Cuanto mayor sea la estabilidad del complejo sigma provoca que los productos orto y para formen más rápido que meta. Generalmente, el para-producto se ve favorecido sobre el orto-producto debido a los efectos estéricos a pesar de que hay dos posiciones orto-.
Mecanismo para la formación de productos orto-dirigidos
Mecanismo para la formación de productos para-dirigidos
orto-, Para-directores vía Inducción
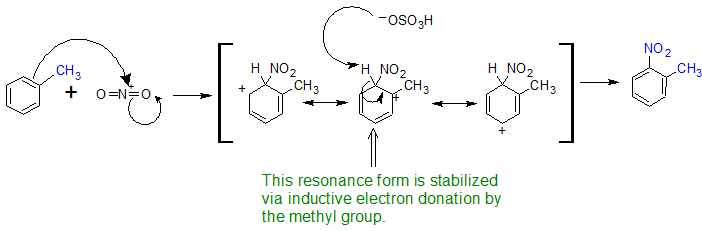
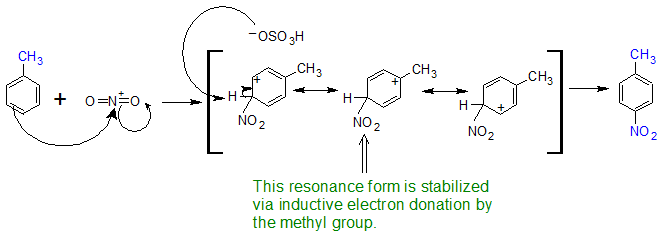
Los grupos alquilo son orto-, para-directores para las reacciones EAS. Se utilizará tolueno para demostrar la dirección orto, para de los sustituyentes que estabilizan el complejo sigma a través de la inducción. El ion nitronio (O=N + =O) se utilizará para representar el electrófilo (E +). Dado que el efecto inductivo es más débil que la resonancia, podemos ver que también se aísla un pequeño porcentaje del meta producto.
Al observar la estabilidad de las estructuras de resonancia del complejo sigma en el mecanismo de reacción para la nitración del tolueno, se explica por qué las orto- y para- sustituciones son los principales productos. Cuando el grupo nitro se suma en la posición orto o para, el grupo metilo estabiliza el estado de transición a través de la donación de electrones por inducción que favorece la formación de los orto- y para- productos. Como se ve con los productos dirigidos por resonancia, el producto para se ve favorecido por los efectos estéricos a pesar de que existen dos posiciones orto-.
Mecanismo para la formación de productos orto-dirigidos
Mecanismo para la formación de productos para-dirigidos
meta Directores - los Grupos Retiradores de Electrones
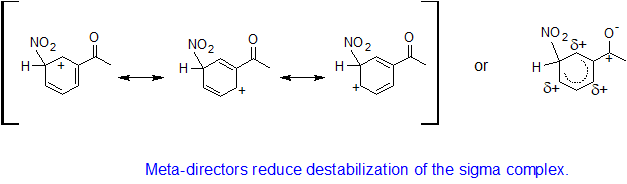
Los grupos receptores de electrones desestabilizan el complejo sigma y desactivan los anillos de benceno a reacciones EAS. Para los grupos receptores de electrones, todos los complejos sigma están desestabilizados. La metaposición es la menos desestabilizada y produce el mayor porcentaje de los productos de reacción.
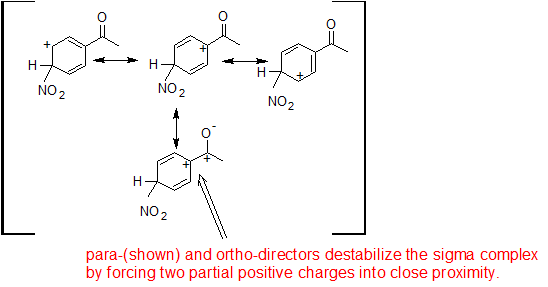
La acetofenona se utilizará para demostrar la reactividad de los meta-directores usando los complejos sigma a continuación. Los grupos acilo son desactivadores de resonancia.
Las reacciones orto y para producen una estructura de resonancia que coloca el catión arenio junto a un catión adicional en el carbono carbonilo. Esta proximidad de cargas positivas parciales desestabiliza el complejo sigma y ralentiza la reacción orto y para.
Por defecto, el meta producto se forma más rápido porque los efectos desestabilizadores se reducen a través de una mayor separación física de las cargas positivas parciales.
Sustituyentes y velocidades de reacción de sustitución aromática electrofílica (EAS)
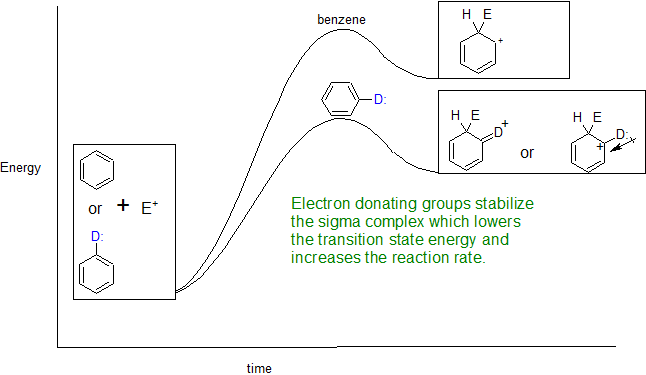
Dado que la formación del complejo sigma es la etapa determinante de la velocidad de las reacciones EAS, los derivados de benceno se dividen en dos grupos en función de cómo el sustituyente estabiliza o desestabiliza el complejo sigma cargado positivamente. La reacción EAS de un anillo sustituido con un grupo activador es más rápida que el benceno. Por otro lado, un anillo sustituido con un grupo desactivado es más lento que el benceno. Los grupos activadores aceleran la reacción EAS por resonancia o donación inductiva de electrones (típicamente grupos R). Para la resonancia, se pueden donar electrones desapareados para estabilizar la carga positiva del complejo sigma en el estado de transición. Estabilizando el intermedio, acelera la reacción bajando la energía activadora. La donación inductiva de electrones por grupos R es un efecto análogo pero más débil que la resonancia. La donación inductiva de electrones ayuda a estabilizar el complejo sigma y acelerar (activar) la reacción. Los grupos desactivadores retiran los electrones del carbocatión del complejo sigma causando desestabilización y aumentando la energía de activación que ralentiza (desactiva) la reacción.
- Anillos activados: los sustituyentes en el anillo donan electrones y aumentan las velocidades de reacción EAS
- Ejemplos de grupos donadores de electrones en el orden relativo desde el grupo más activante hasta el menos activador:
-NH 2, -NR 2 > -OH, -OR> -NHCOR> -CH 3 y otros grupos alquilo con R como grupos alquilo (C n H 2n +1)
- Ejemplos de grupos donadores de electrones en el orden relativo desde el grupo más activante hasta el menos activador:
A continuación se muestra el diagrama de energía de reacción que ilustra el efecto sustituyente de los grupos donadores de electrones (D:) sobre las velocidades de reacción de EAS.
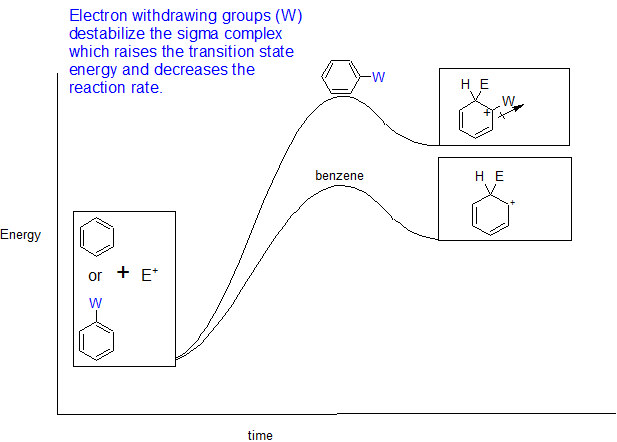
- Anillos desactivados: los sustituyentes en el anillo retiran electrones y disminuyen las velocidades de reacción EAS
- Ejemplos de grupos de retirada de electrones en el orden relativo desde los más desactivantes hasta los menos desactivantes:
-NO 2, -CF 3 > -COR, -CN, -CO 2 R, -SO 3 H > Halógenos con R como grupos alquilo (C n H 2n +1)
- Ejemplos de grupos de retirada de electrones en el orden relativo desde los más desactivantes hasta los menos desactivantes:

El diagrama de energía de reacción que ilustra el efecto sustituyente de los grupos aceptores de electrones (W) sobre la velocidad de reacción de EAS se muestra a continuación.
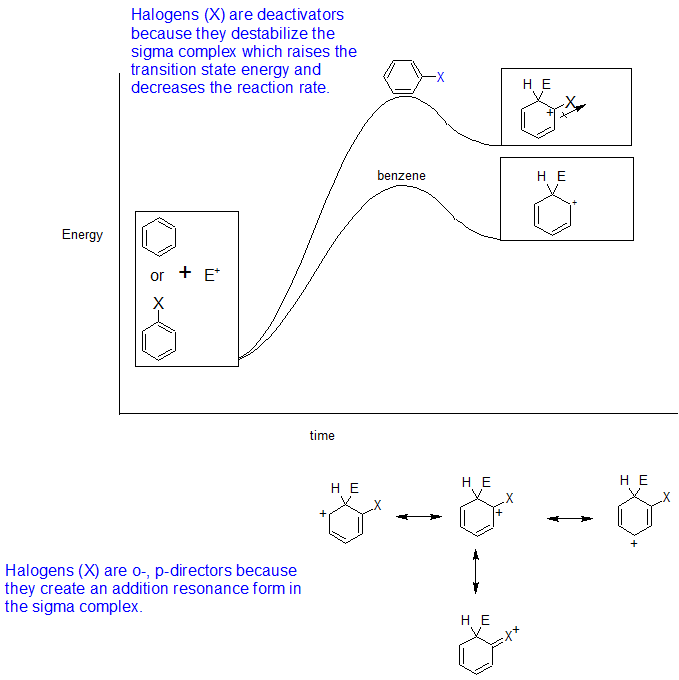
- La paradoja halógena: desactivadores que son orto, para-directores
Los halógenos desactivan los anillos a reacciones EAS posteriores. El orden de reactividad de los anillos de benceno hacia la sustitución electrófila cuando se sustituye con un grupo halógeno, sigue el orden de electronegatividad.
F> Cl > Br > I
El anillo que está sustituido con el halógeno más electronegativo es el anillo más reactivo (menos sustituyente desactivante) y el anillo que está sustituido con el halógeno menos electronegatvie es el anillo menos reactivo (sustituyente más desactivante). El tamaño del halógeno también afecta la reactividad del anillo de benceno - a medida que aumenta el tamaño del halógeno, la reactividad del anillo disminuye.
Sin embargo, los electrones de par solitario en los átomos de halógeno todavía están disponibles para la deslocalización por resonancia en el complejo sigma causando orto-, para-dirección del electrófilo. El siguiente diagrama de energía de reacción resuelve estos aspectos contradictorios de las reacciones EAS de derivados de benceno halogenados.
Referencias
- Schore, N.E. y P.C. Vollhardt. 2007. Química Orgánica, estructura y función, 5ª ed. Nueva York, NY: W.H. Freeman and Company.
- Fryhle, C.B. y G. Solomons. 2008. Química Orgánica, 9º ed.Danvers, MA: Wiley.
Enlaces externos
- http://en.Wikipedia.org/wiki/Activating_group
- http://en.Wikipedia.org/wiki/Deactivating_group
- http://www.columbia.edu/itc/chemistry/c3045/client_edit/ppt/PDF/12_12_14.pdf
En un alcohol terciario (3°), el átomo de carbono que contiene el grupo -OH está unido directamente a tres grupos alquilo, que pueden ser cualquier combinación del mismo o diferente. Ejemplos:
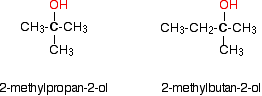
Ejercicios
13. Predecir la dirección de la substición electrófila en estos anillos:
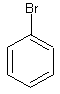
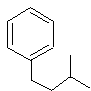
14. ¿Qué producto de nitración se va a formar más rápido?
nitración de anilina o nitración de nitrobenceno?
15. Predecir el producto de las siguientes dos reacciones de sulfonación:
A.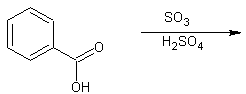
16. Clasifique estos dos grupos como grupos activadores o desactivadores:
A. alcohol
B. éster
17. ¿Por qué efecto afecta el tricloruro a un anillo monosustituido?
18. El triclorometilbenceno tiene una fuerte concentración de electrones en el sustituyente metilo. Comparando este compuesto con tolueno, ¿cuál es más reactivo hacia la sustitución electrofílica?
19. El siguiente compuesto es menos reactivo hacia la sustitución electrófila que la anilina? Explique.
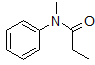
20. Considere los intermedios de la siguiente molécula durante una sustitución electrófila. Dibujar estructuras de resonancia para reacciones orto, meta y para.

- Responder
-
13. La primera sustitución va a ser la sustitución orto y/o para ya que tenemos un subtituente halógeno. La segunda substición va a ser la sustitución orto y/o para también ya que tenemos un sustituyente alquilo.
14. La nitración de anilina va a ser más rápida que la nitración del nitrobenceno, ya que la anilina es un anillo con sustituyente NH 2 y el nitrobenceno es un anillo con sustituyente NO 2. Como se describió anteriormente, NH 2 es un grupo activador que acelera la reacción y NO 2 es un grupo desactivante que ralentiza la reacción.
15.
A. el producto es
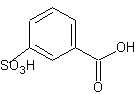
B. el producto es
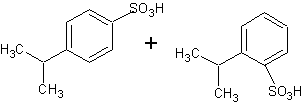
16.
A. el alcohol es un grupo activador.
B. éster es un grupo desactivante.
17. El tricloruro desactiva un anillo monosustituido por efecto inductivo.
18. El grupo triclorometilo es un donador de electrones en el anillo de benceno, por lo que lo hace más estable y por lo tanto más reactivo en comparación con la sustitución electrófila.
19. Como se ve en resonancia, la densidad electrónica también se localiza fuera del anillo, desactivándola en comparación con la anilina.

20.
.png)
Ejercicios
16.5 Una explicación de los efectos de los sustituyentes
16.5 Ejercicios
Preguntas
Q16.5.1
El (triclorometil) benceno tiene una fuerte concentración de electrones en el sustituyente metilo. Comparando este tolueno, ¿cuál es más reactivo hacia la sustitución electrofílica?
Q16.5.2
El siguiente compuesto es menos reactivo hacia la sustitución electrófila que la anilina? Explique.
Q16.5.3
Considere los intermedios de la siguiente molécula durante una sustitución electrófila. Dibujar estructuras de resonancia para ataques orto, meta y para.

Soluciones
S16.5.1
El grupo triclorometilo es un donador de electrones en el anillo de benceno, por lo que lo hace más estable y por lo tanto más reactivo en comparación con la sustitución electrófila.
S16.5.2
Como se ve en resonancia, la densidad electrónica también se localiza fuera del anillo, desactivándola en comparación con la anilina.

S16.5.3
.png)
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
- Lana Alawwad (UCD)