18.7: Reacciones en cadena lateral de derivados de benceno
- Page ID
- 76075
Oxidación de cadenas laterales de alquilo
Hay otra reacción que ocurre en el átomo directamente unido a un anillo aromático. Esto se conoce como “oxidación de cadena lateral”. Cuando un compuesto que tiene un grupo alquilo directamente unido a un grupo arilo se trata con un agente oxidante fuerte como permanganato de potasio (KMnO 4) o Reactivo Jones (CrO 3/H 2 SO 4), el carbono bencílico se oxida a un grupo ácido carboxílico que permanece unido al grupo arilo. Cualquier otro enlace carbono-carbono en el grupo alquilo se rompe. Para la reacción de oxidación, el número de átomos de carbono en la cadena lateral alquílica no importa, sin embargo, el carbono bencílico debe tener al menos un hidrógeno bencílico unido. Así, los carbonos terciarios unidos a un anillo aromático no se ven afectados por estas reacciones. Cabe señalar que durante esta reacción un grupo alquilo director orto/para se convierte en un carboxílico dirigido a meta.
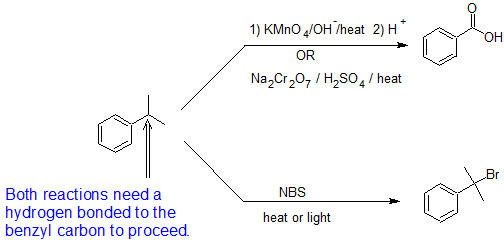
Añadir terciario sin reacción
A continuación se dan otros dos ejemplos de esta reacción, e ilustran su utilidad en la preparación de ácidos benzoicos sustituidos.
Añadir cadena de estrechamiento y tertirario.
El mecanismo de esta reacción es oscuro, pero el hecho de que específicamente requiera que haya un enlace C-H bencílico sugiere que romper este enlace es esencial. Cualquier intermedio que pueda formarse rompiendo este enlace se estabilizará por resonancia con el grupo arilo, lo que proporciona una explicación de la especificidad del ataque en la posición bencílica. Tales reacciones también ocurren en un contexto biológico. Las enzimas oxidan las cadenas laterales de alquilo en anillos aromáticos como parte de hacer que dichos compuestos sean lo suficientemente solubles como para ser eliminados.
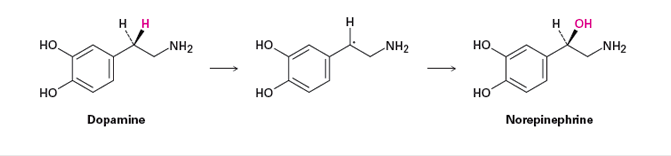
Oxidaciones análogas de cadena lateral ocurren en diversas vías biosintéticas. El neurotransmisor norepinefrina, por ejemplo, se biosintetiza a partir de dopamina mediante una reacción de hidroxilación bencílica. El proceso es catalizado por la enzima dopamina que contiene cobre
Bromación del Carbono Bencílico
La reacción de bromación es el radical N-bromosuccinamida (NBS), reacción de sustitución previamente estudiada. Al igual que con la reacción de oxidación, se necesita un hidrógeno bencílico para que pueda ser sustituido con bromo. A continuación se muestran ejemplos de ambas reacciones.
El reactivo bromante, N-bromosuccinimida (NBS), ha demostrado ser útil para lograr la sustitución alílica o bencílica en solución de CCl 4 a temperaturas por debajo de su punto de ebullición (77 ºC). Una de tales aplicaciones se muestra en la segunda ecuación. la bromación alílica con NBS es analágica a la reacción de halogenación de alcanos (Sección 10.3) ya que también ocurre como reacción en cadena radical. El NBS sirve como fuente para el bromo, que se utiliza en la etapa de iniciación para crear un radical bromo que luego abstrae un protón de la posición alílica en la etapa de propagación. El radical creado luego reacciona con el NBS para bromiarse y el ciclo continúa hasta que se termina.
El predominio de la sustitución alílica sobre otras posiciones se reduce a las energías de disociación de enlace. Las energías relativas de disociación del enlace se muestran en la tabla en la parte superior de esta sección. El enlace C-H en el que nos estamos enfocando como punto de diferencia para cada una de las energías muestra que el enlace C-H alílico tiene una fuerza de aproximadamente 88 kcal/mol. Esto significa que el radical alílico creado es más estable que un radical alquilo típico con la misma sustitución en aproximadamente 9 kcal/mol. Por lo tanto, este radical es el más probable de formarse y así reaccionar.
Los enlaces bencílicos C-H son más débiles que la mayoría de los C-H hibridados con sp 3. Esto se debe a que el radical formado por la homólisis está estabilizado por resonancia.
Estabilización de resonancia del radical bencílico
Debido a los débiles enlaces C-H, los hidrógenos bencílicos pueden formar haluros bencílicos en condiciones radicales.
NBS como fuente de bromo
La NBS (N-bromosuccinimida) es el reactivo más utilizado para producir bajas concentraciones de bromo. Cuando se suspende en tetracloruro (CCl 4), el NBS reacciona con trazas de HBr para producir una concentración suficientemente baja de bromo para facilitar la reacción de bromación alílica.
.jpg)
Mecanismo de bromación alílico
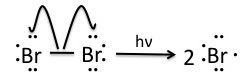
Paso 1: Iniciación
Una vez que la etapa de preiniciación que involucra NBS produce pequeñas cantidades de Br 2, las moléculas de bromo se escinden homolíticamente por la luz para producir radicales de bromo.
Paso 2 y 3: Propagación
Paso 4: Terminación
Reducciones de cadena lateral acilo
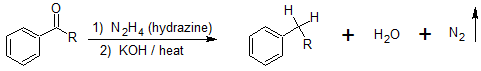
Dado que existen varias limitaciones a la alquilación de Friedel-Crafts que no se observan con la acilación de Friedel-Crafts, la reducción de la cadena lateral de acilo a una cadena lateral de alquilo es una reacción útil para la síntesis de múltiples etapas. La reacción de Wolff-Kishner reduce los grupos de carbono (aldehídos y cetonas) a alcanos y no se limita a grupos acilo unidos a anillos de benceno. Esta reacción de reducción de acilo también es útil porque los grupos acilo están desactivando, los meta-directores y los grupos alquilo son activadores, orto-, para-directores, lo que agrega flexibilidad a las estrategias de síntesis de múltiples etapas.
Ejercicio
21. Dibuje las estructuras de la línea de unión para el/los producto (s) de las siguientes reacciones.
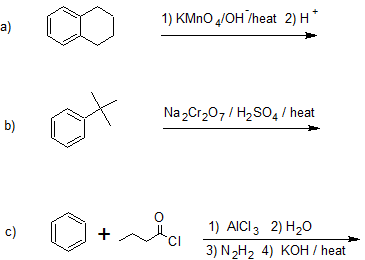
- Contestar
-
21.
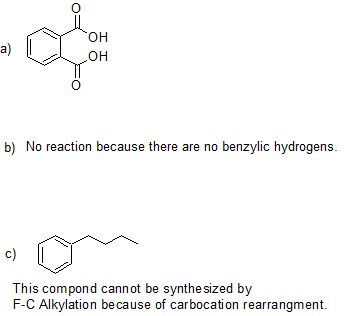
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

