20.1: Estructura y Propiedades Físicas de las Aminas
- Page ID
- 76139
Estructura
Las aminas suelen tener tres enlaces y un par de electrones de pares solitarios. Esto hace que el nitrógeno sp 3 se hibride, piramidal trigonal, con un ángulo de enlace de aproximadamente 109.5 o.
Estereoquímica
El nitrógeno de enlace simple tiene forma piramidal, con el par de electrones sin enlace apuntando a la esquina desocupada de una región tetraédrica. Dado que el nitrógeno en estos compuestos está unido a tres grupos diferentes, es estereogénico y su configuración es quiral. Las configuraciones de imagen especular no idénticas se ilustran en el siguiente diagrama (el resto de la molécula está representado por R, y el par de electrones es de color amarillo). Si estas configuraciones fueran estables, habría cuatro estereoisómeros adicionales de efedrina y pseudoefedrina. Sin embargo, el nitrógeno piramidal normalmente no es configuracionalmente estable. Rápidamente invierte su configuración (flechas de equilibrio) al pasar por un estado de transición plano hibridado sp 2, lo que lleva a una mezcla de configuraciones R y S interconvertidoras. Si el átomo de nitrógeno fuera el único centro quiral en la molécula, existiría en equilibrio una mezcla 50:50 (racémica) de configuraciones R y S. Si están presentes otros centros quirales, como en los isómeros de la efedrina, resultará una mezcla de diastereómeros. El mensaje para llevar a casa es que el nitrógeno no contribuye a los estereoisómeros aislables.
Las aminas se clasifican según el número de grupos alquilo o arilo unidos al nitrógeno. Las aminas se clasifican de manera diferente a los haluros y alcoholes de alquilo porque el nitrógeno tiene un patrón de unión neutra de tres enlaces con un solo par solitario. Para clasificar las aminas, observamos el átomo de nitrógeno de la amina y contamos el número de grupos alquilo unidos a ella. Este número es la clasificación de la amina.
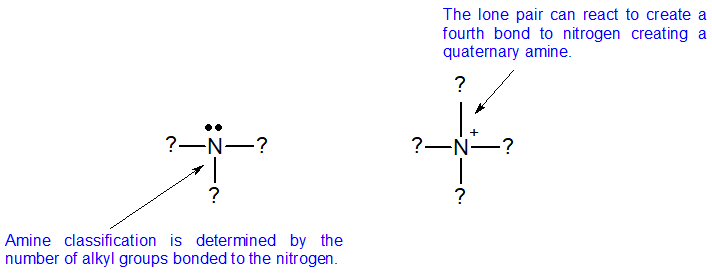

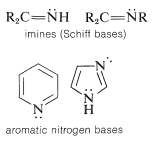
Hay dos clasificaciones adicionales de aminas. Cuando el nitrógeno está doblemente unido al carbono, entonces se llama am imina. Cuando el nitrógeno es parte de un anillo que incluye dobles enlaces, entonces se clasifica como heterocíclico, como se ve en las bases nitrogenadas aromáticas que se muestran a continuación.
Punto de ebullición y solubilidad en agua
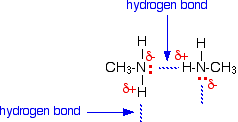
Es instructivo comparar los puntos de ebullición y la solubilidad en agua de las aminas con los de los alcoholes y éteres correspondientes. El factor dominante aquí es el enlace de hidrógeno, y la primera tabla a continuación documenta la poderosa atracción intermolecular que resulta del enlace de hidrógeno -O-H — O- en alcoholes (columnas de color azul claro). El enlace de hidrógeno -N-H — N- correspondiente es más débil, como lo demuestran los puntos de ebullición más bajos de aminas de tamaño similar (columnas de color verde claro). Los alcanos proporcionan compuestos de referencia en los que los enlaces de hidrógeno no son posibles, y el aumento en el punto de ebullición para las aminas 1º-equivalentes es aproximadamente la mitad del aumento observado para alcoholes equivalentes.
| Compuesto | CH 3 CH 3 | CH 3 OH | CH 3 NH 2 | CH 3 CH 2 CH 3 | CH 3 CH 2 OH | CH 3 CH 2 NH 2 |
|---|---|---|---|---|---|---|
| Mol.Wt. | 30 | 32 | 31 | 44 | 46 | 45 |
| Punto de ebullición ºC |
-88.6º | 65º | -6.0º | -42º | 78.5º | 16.6º |
La segunda tabla ilustra las diferencias asociadas a las aminas isoméricas de 1º, 2º y 3º-aminas, así como la influencia de la ramificación de la cadena. Dado que las 1º-aminas tienen dos hidrógenos disponibles para enlaces de hidrógeno, esperamos que tengan puntos de ebullición más altos que las 2º-aminas isoméricas, que a su vez deberían hervir más que las 3º-aminas isoméricas (sin enlaces de hidrógeno). De hecho, las 3º-aminas tienen puntos de ebullición similares a los éteres de tamaño equivalente; y en todos menos los compuestos más pequeños, los correspondientes éteres, 3º-aminas y alcanos tienen puntos de ebullición similares. En los ejemplos aquí mostrados, se demuestra además que la ramificación de la cadena reduce los puntos de ebullición entre 10 y 15 ºC.
| Compuesto | CH 3 (CH 2) 2 CH 3 | CH 3 (CH 2) 2 OH | CH 3 (CH 2) 2 NH 2 | CH 3 CH 2 NHCH 3 | (CH 3) 3 CH | (CH 3) 2 CHOH | (CH 3) 2 CHNH 2 | (CH 3) 3 N |
|---|---|---|---|---|---|---|---|---|
| Mol.Wt. | 58 | 60 | 59 | 59 | 58 | 60 | 59 | 59 |
| Punto de ebullición ºC |
-0.5º | 97º | 48º | 37º | -12º | 82º | 34º | 3º |
La solubilidad en agua de las aminas 1º y 2º-es similar a la de alcoholes comparables. Como era de esperar, la solubilidad en agua de 3º-aminas y éteres también es similar. Estas comparaciones, sin embargo, son válidas solo para compuestos puros en agua neutra. La basicidad de las aminas (siguiente sección) permite que se disuelvan en soluciones diluídas de ácidos minerales, y esta propiedad facilita su separación de compuestos neutros como alcoholes e hidrocarburos dividiendo entre las fases de disolventes no miscibles.
Olor
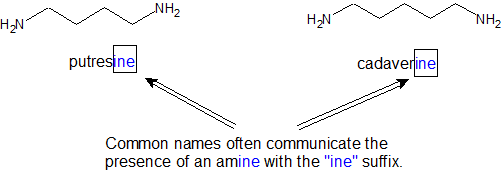
La forma de base libre de las aminas puede ser bastante odiferente. El mal olor a carne moribunda proviene principalmente de las aminas liberadas durante la descomposición de las proteínas en un organismo. Los nombres comunes para las aminas a continuación enfatizan este aspecto de las aminas. También es útil señalar que los nombres comunes frecuentemente indican la presencia de una amina con el sufijo “ine”.
El olor a aminas se puede reducir haciéndolas reaccionar con ácidos fuertes para formar las sales de amonio. Por ejemplo, el ácido de los limones se puede utilizar para disimular el olor a pescado que está más allá de una frescura óptima. Mientras que las formas de base libre de aminas pueden ser térmicamente inestables y malolientes, la sal de amonio formada a partir del ácido conjugado de la amina tiene mayor estabilidad térmica y menor olor. Si la amina no es soluble como base libre, su sal de amonio será soluble en agua.
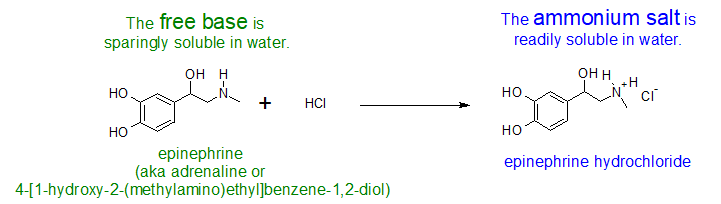
Ejercicio
1. Dibujar las estructuras para las siguientes aminas en orden decreciente de solubilidad en agua: metanamina, 2-octanamina, 2-butanamina.
2. Extraer las para las siguientes aminas en orden decreciente del punto de ebullición: ciclohexanamina, 2-octanamina, 2-butanamina.
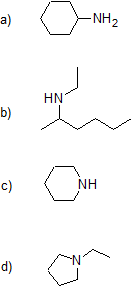
3. Clasificar las siguientes aminas.
- Responder
-
1.
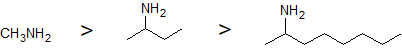
2.
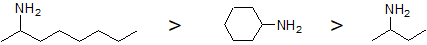
3. a) primaria b) secundaria c) secundaria d) terciaria
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

