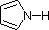20.2: Basicidad de Aminas y Formación de Sal de Amonio
- Page ID
- 76118
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Basicidad de los grupos nitrogenados
Al evaluar la basicidad relativa de varios grupos funcionales que contienen nitrógeno: aminas, amidas, anilinas, iminas y nitrilos, la pregunta central es: ¿qué tan reactivo (y por lo tanto, qué tan básico) es el par solitario sobre el nitrógeno? En otras palabras, ¿cuánto quiere romper ese par solitario del núcleo de nitrógeno y formar un nuevo enlace con un hidrógeno?
Comparación de la basicidad de las alquilaminas con el amoníaco
Los grupos alquilo donan electrones al nitrógeno más electronegativo. Este efecto inductivo hace que la densidad de electrones en el nitrógeno de la alquilamina sea mayor que el nitrógeno del amonio. Correspondientemente, las alquilaminas primarias, secundarias y terciarias son más básicas que el amoníaco. Los efectos inductivos también son moderados por el aumento del impedimento estérico de los grupos alquilo (R grps).
Comparación de la basicidad de las alquilaminas con las amidas
Con una alquilamina el electrón de par solitario se localiza en el nitrógeno. Sin embargo, el electrón de par solitario en una amida se deslocaliza entre el nitrógeno y el oxígeno a través de resonancia. Esto hace que las amidas sean mucho menos básicas en comparación con las alquilaminas.
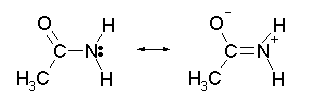
Cuando una amida reacciona con un ácido, la protonación ocurre en el oxígeno carbonílico y no en el nitrógeno. El catión resultante de la protonación de oxígeno se estabiliza por resonancia., mientras que el catión resultante de la protonación de nitrógeno no se estabiliza por resonancia.
Basicidad de aminas heterocíclicas
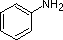
Cuando un átomo de nitrógeno se incorpora directamente a un anillo aromático, su basicidad depende del contexto de unión. En un anillo de piridina, por ejemplo, el par solitario de nitrógeno ocupa un orbital híbrido sp 2, y no forma parte del sexteto aromático, es esencialmente un nitrógeno imino. Su par de electrones está disponible para formar un enlace a un protón, y así el átomo de nitrógeno de piridina es algo básico.

En un anillo pirrol, en contraste, el par solitario de nitrógeno es parte del sexteto aromático. Esto significa que estos electrones son muy estables justo donde están (en el sistema aromático), y están mucho menos disponibles para enlazarse a un protón (y si captan un protón, el sistema aromático se destruye). Por estas razones, los nitrógenos de pirrol no son fuertemente básicos.

Los ejemplos de anilina, piridina y pirrol son buenos modelos para predecir la reactividad de los átomos de nitrógeno en sistemas de anillos más complejos (una gran diversidad de los cuales se encuentran en la naturaleza). La cadena lateral del triptófano, por ejemplo, contiene un nitrógeno no básico 'similar al pirrol', mientras que la adenina (una base de ADN/ARN) contiene los tres tipos.

Los electrones de par solitario en el nitrógeno de un nitrilo están contenidos en un orbital híbrido sp. El carácter del 50% s de un orbital híbrido sp significa que los electrones están cerca del núcleo y por lo tanto no significativamente básicos.
Fuerza base y valores de pKa
Al igual que el amoníaco, la mayoría de las aminas son bases de Brønsted y Lewis, pero su fuerza de base puede ser cambiada enormemente por sustituyentes. Es común comparar cuantitativamente la basicidad usando los pK a de sus ácidos conjugados en lugar de sus pK b. Dado que pK a + pK b = 14, cuanto mayor sea el pK a, más fuerte será la base, en contraste con la relación inversa habitual de pK a con acidez. La mayoría de las alquilaminas simples tienen pK a en el rango de 9.5 a 11.0, y sus soluciones acuosas son básicas (tienen un pH de 11 a 12, dependiendo de la concentración).
|
Compuesto |
 |
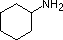 |
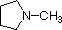 |
NH 3 |
piridina |
anilina |
4-nitroanilina |
pirrol |
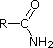 |
CH 3 C=N acetonitrilo |
|---|---|---|---|---|---|---|---|---|---|---|
| pK a | 11.0 | 10.7 | 10.7 | 9.3 | 5.2 | 4.6 | 1.0 | 0.0 | -1.0 | -10. |
Los primeros cuatro compuestos de la tabla anterior son todos bases débiles. Los últimos cinco compuestos son significativamente menos básicos a neutros e incluso ácidos como consecuencia de dos posibles factores:
- hibridación orbital
- deslocalización de electrones a través de resonancia.
En piridina, el nitrógeno es sp 2 hibridado, y en nitrilos (última entrada) un nitrógeno híbrido sp es parte del triple enlace. En cada uno de estos compuestos, el par de electrones no enlazantes se localiza en el átomo de nitrógeno, pero aumentando el carácter s lo acerca al núcleo de nitrógeno, reduciendo su tendencia a enlazarse a un protón. Para anilina y 4-nitroanilina, el par solitario de nitrógeno se estabiliza mediante hiperconjugación con el anillo aromático. El pirrol presenta una deslocalización excepcional del par de electrones de nitrógeno debido a su incorporación en el anillo aromático.
Aunque la deslocalización por resonancia generalmente reduce la basicidad de las aminas, un ejemplo dramático del efecto inverso se encuentra en el compuesto guanidina (pK a = 13.6). Aquí, como se muestra a continuación, la estabilización por resonancia de la base es pequeña, debido a la separación de carga, mientras que el ácido conjugado se estabiliza fuertemente por deslocalización de carga. En consecuencia, las soluciones acuosas de guanidina son casi tan básicas como las soluciones de hidróxido de sodio.
Las bases fuertes tienen ácidos conjugados débiles y las bases débiles tienen ácidos conjugados fuertes.
Extracción de Amina en Laboratorio
La extracción se emplea a menudo en la química orgánica para purificar compuestos. Las extracciones líquido-líquido aprovechan la diferencia de solubilidad de una sustancia en dos líquidos inmiscibles (por ejemplo, éter y agua). Los dos líquidos inmiscibles utilizados en un proceso de extracción son (1) el disolvente en el que se disuelven los sólidos, y (2) el disolvente de extracción. Los dos líquidos inmiscibles se separan fácilmente usando un embudo separador. Para las aminas se puede aprovechar su basicidad formando la sal protonada (RNH 2 + Cl −), la cual es soluble en agua. La sal se extraerá en la fase acuosa dejando atrás compuestos neutros en la fase no acuosa. Luego se trata la capa acuosa con una base (NaOH) para regenerar la amina y NaCl. Luego se realiza una segunda extracción-separación para aislar la amina en la capa no acuosa y dejar atrás NaCl en la capa acuosa.
Bases Reactivas Importantes
La importancia de todas estas relaciones ácido-base para la química orgánica práctica radica en la necesidad de bases orgánicas de fuerza variable, como reactivos adaptados a los requerimientos de reacciones específicas. El hidróxido de sodio de base común no es soluble en muchos disolventes orgánicos y, por lo tanto, no se usa ampliamente como reactivo en reacciones orgánicas. La mayoría de los reactivos básicos son sales alcóxido, aminas o sales de amida. Dado que los alcoholes son ácidos mucho más fuertes que las aminas, sus bases conjugadas son más débiles que las bases amida, y llenan el hueco en la fuerza de base entre las aminas y las sales de amida. En la siguiente tabla, pK a nuevamente se refiere al ácido conjugado de la base dibujada por encima del mismo.
| Nombre Base | Piridina | Trietil amina |
Base de Hünig | Base de Barton |
T-butóxido de potasio |
Sodio HMDS | LDA |
|---|---|---|---|---|---|---|---|
| Fórmula |  |
(C 2 H 5) 3 N | 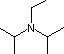 |
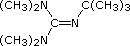 |
(CH 3) 3 CO (—) K (+) | [(CH 3) 3 Si] 2 N (—) Na (+) | [(CH 3) 2 CH] 2 N (—) Li (+) |
| pK a | 5.3 | 10.7 | 11.4 | 14 | 19 | 26 | 35.7 |
La piridina se usa comúnmente como un depurador de ácido en reacciones que producen coproductos de ácidos minerales. Su basicidad y nucleofilia pueden ser modificadas por impedimento estérico, como en el caso de 2,6-dimetilpiridina (pK a =6.7), o estabilización por resonancia, como en el caso de 4-dimetilaminopiridina (pK a =9.7). La base de Hünig es relativamente no nucleofílica (debido al impedimento estérico), y al igual que la DBU se usa a menudo como base en reacciones de eliminación de E2 realizadas en disolventes no polares. La base de Barton es una base fuerte, poco nucleofílica y neutra que sirve en casos donde la sustitución electrófila de DBU u otras bases amínicas es un problema. Los alcóxidos son bases más fuertes que a menudo se utilizan en el alcohol correspondiente como disolvente, o para mayor reactividad en DMSO. Finalmente, las dos bases amida ven un uso generalizado en la generación de bases enolato a partir de compuestos carbonílicos y otros ácidos de carbono débiles.
Formación de sal de amonio y solubilidad en agua
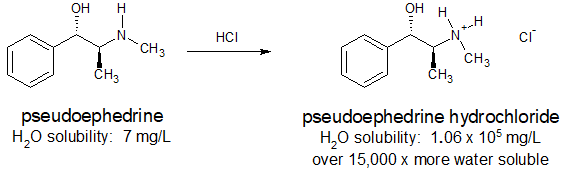
Muchos productos farmacéuticos incluyen grupos funcionales amina. En ocasiones la basicidad de estos grupos amina se utiliza para aumentar la solubilidad en agua de un fármaco de manera que se pueda administrar por vía oral o intravenosa. Las sales de amonio también son térmicamente más estables y tienen menos olor que sus conjugados de “base libre”. El antihistamínico, pseudoefedrina, reacciona con ácido clorhídrico para formar la sal de amonio soluble en agua como se muestra a continuación.
Ejercicio
4. Seleccione el compuesto más básico de cada uno de los siguientes pares de compuestos.
(a)
b)
c)
5. El ion 4-metilbencilamonio tiene un pKa de 9.51, y el ion butilamonio tiene un pKa de 10.59. ¿Cuál es más básico? ¿Cuál es el PkB para cada compuesto?
6. A continuación se muestran las estructuras para indol e imidazol. Un compuesto tiene un pKa de -2 mientras que el otro compuesto tiene un pKa de 7. Asigne los valores de pKa al compuesto correspondiente y explique su razonamiento.

- Contestar
-
4.
(a)

b)

c)

5. El butilamonio es más básico. El pKb para butilamonio es 3.41, el pKb para 4-metilbencilamonio es 4.49.
6.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)