22.2: Espectroscopia de Derivados de Ácido Carboxílico
- Page ID
- 76554
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Espectroscopía Infrarroja (IR)
Si bien todos los derivados de ácido carboxílico incluyen un grupo carbonilo, los heteroátomos que caracterizan al derivado pueden usarse para distinguir entre los derivados. Adicionalmente, existe una correlación útil entre la reactividad de los derivados de ácido carboxílico y sus frecuencias de estiramiento de carbonilo. Así, los haluros y anhidridos de acilo muy reactivos absorben a frecuencias significativamente mayores, mientras que las amidas relativamente no reactivas absorben a frecuencias más bajas. Las características espectrales IR que se pueden utilizar para determinar la identidad de los derivados de ácido carboxílico se enumeran a continuación. Los espectros infrarrojos de muchos derivados de ácido carboxílico se mostrarán en la figura debajo de la tabla haciendo clic en los botones correspondientes que allí se presentan.
|
Derivado de carbonilo |
Absorción de carbonilo |
Comentarios |
|---|---|---|
|
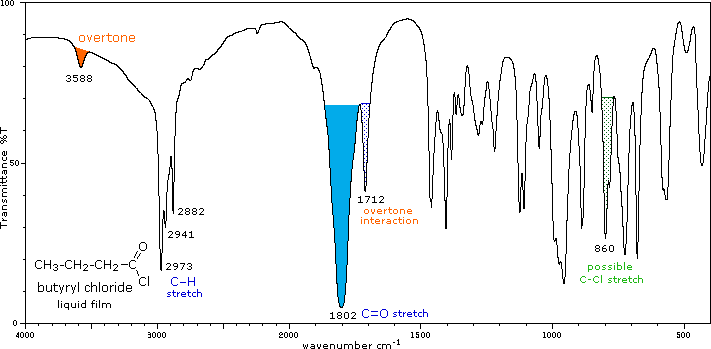
Halouros de acilo ( |
C=O estiramiento |
La conjugación disminuye las frecuencias C=O reportadas aquí, al igual que con aldehídos y cetonas. En los cloruros de acilo un hombro o pico de menor intensidad cerca de 1740 cm -1 se debe a una interacción de sobretono. |
|
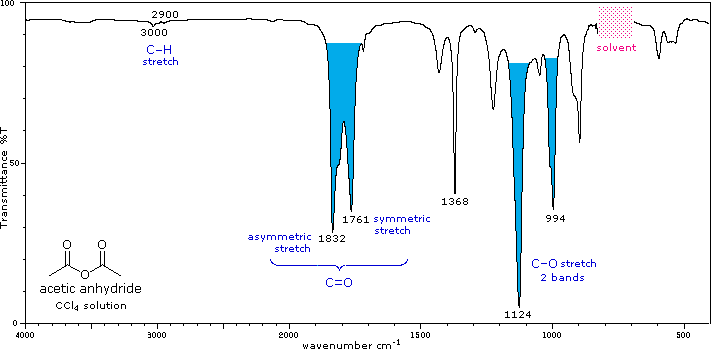
Anhídrido de ácido, (RCO) 2 O anillo |
C=O stretch (2 bandas) |
La conjugación disminuye las frecuencias C=O reportadas aquí, al igual que con aldehídos y cetonas. Las dos bandas de estiramiento están separadas por 60 ± 30 cm -1, y para los anhidridos acíclicos la banda de mayor frecuencia (estiramiento asimétrico) es más fuerte que la absorción de menor frecuencia (simétrica). Los anhidridos cíclicos también muestran dos absorciones de estiramiento de carbonilo, pero la banda de frecuencia más baja es la más fuerte. Se observan una o dos bandas de estiramiento -CO-O-CO- en la región de 1000 a 1300 cm -1. |
|
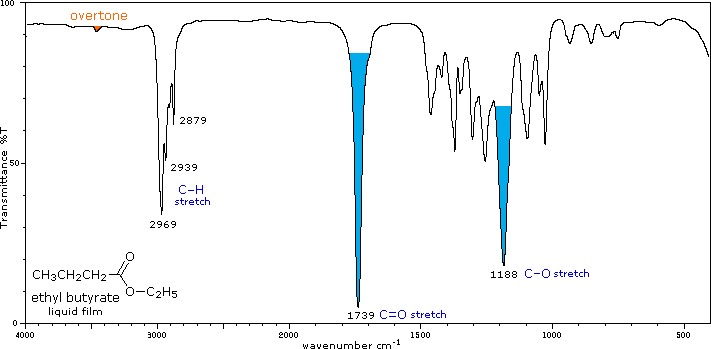
Ésteres y lactonas (RCOOR') |
C=O estiramiento |
La conjugación disminuye las frecuencias C=O reportadas aquí, ya que con aldehídos y cetonas se encuentran fuertes absorciones de estiramiento CO-O (una o dos) de 1150 a 1250 cm -1 |
|
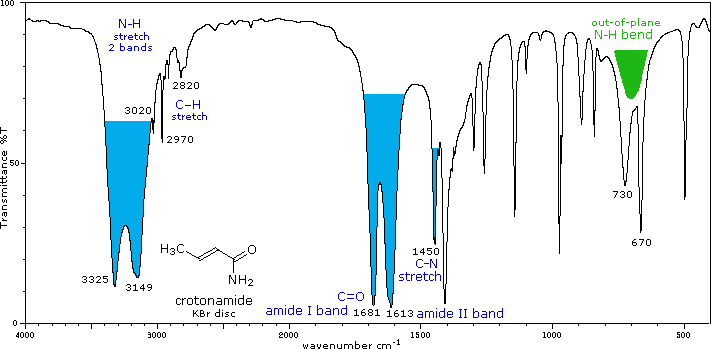
Amidas y lactamas (RCONR 2) |
Bandas C=O |
El efecto de la conjugación es mucho menor que para aldehídos y cetonas. La mayor frecuencia de absorción (1665± 30) se denomina banda Amida I. La banda de amida II de menor frecuencia (1620± 30 en amidas 1° y 1530± 30 en 2° amidas) se debe en gran parte a la flexión N-H trans al oxígeno carbonilo. En muestras concentradas esta absorción a menudo se ve oscurecida por la absorción de amida I más fuerte. La asociación con enlaces de hidrógeno desplaza algunas de estas absorciones, así como las prominentes absorciones de estiramiento N-H. Estiramiento N-H: 3170 a 3500 cm -1. Dos bandas para 1°-amidas, una para 2°-amidas. |
Espectros de RMN
Para RMN, existen algunas características espectrales que pueden ayudar a identificar el derivado de ácido carboxílico. Los protones en los carbonos adyacentes a los carbonilos absorben a ~2.0-2.5 ppm. Para las amidas, los protones N-H unidos a aminas primarias y secundarias absorben a ~7.5-8.5. Para la RMN de 13 C, el carbono carbonilo en derivados de ácido carboxílico se muestra entre ~ 160-180 ppm con el carbono en un nitrilo apareciendo ~ 115-120 ppm en su RMN de 13 C debido a su hibridación sp.
Ejercicio
2. Los ésteres son conocidos por sus aromas dulces y afrutados. El compuesto P huele a piña y se utiliza como potenciador del sabor para los jugos de naranja. El Compuesto Q es responsable del olor dulce de las manzanas Red Delicious. Los compuestos P y Q son isómeros estructurales con la siguiente composición: 62.04% C, 0.41% H y 27.55% O. El espectro IR para cada compuesto incluye varias bandas moderadas alrededor de 2940 cm-1, una banda fuerte cerca de 1740 cm-1 y una banda moderada cercana a 1200 cm-1. El espectro de RMN 1H y 13C para cada compuesto se muestra a continuación.
Nombre, dibuje la estructura de la línea de enlace y correlacione las señales de RMN con sus respectivos compuestos.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry
Jim Clark (Chemguide.co.uk)



