22.7: Química de Amidas
- Page ID
- 76531
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Síntesis de Amidas
Existen cinco rutas sintéticas para producir amidas: la conversión de nitrilo y las reacciones de sustitución acil-nucleofílica de haluros de ácido, anhidridos de ácido y ácidos carboxílicos.
Los nitrilos se pueden convertir en amidas. Esta reacción puede ser catalizada por ácido o base

El ácido carboxílico se puede convertir en amidas usando DCC como agente activador.

Conversión directa de un ácido carboxílico a una amida por reacción con una amina.

Los cloruros de ácido reaccionan con amoníaco, 1 o aminas y 2 o aminas para formar amidas

Los anhidridos de ácido reaccionan con amoníaco, 1 o aminas y 2 o aminas para formar amidas

Hidrólisis de Amidas
Hidrólisis en condiciones ácidas
Tomar acetamida (etanamida) como amida típica. Si la acetamida se calienta con un ácido diluido (como el ácido clorhídrico diluido), el ácido acético se forma junto con los iones de amonio. Entonces, si estuvieras usando ácido clorhídrico, la solución final contendría cloruro de amonio y ácido acético.
Hidrólisis en condiciones alcalinas
Además, si la acetamida se calienta con solución de hidróxido de sodio, se desprende gas amoníaco y se deja con una solución que contiene acetato de sodio.
Hidrólisis peptídica
La hidrólisis peptídica de las proteínas es la hidrólisis de amida. Lo que los biólogos y bioquímicos llaman un enlace peptídico (en proteínas, por ejemplo) es lo que los químicos llaman un enlace amida. Aplicar cualquiera de las reacciones de hidrólisis anteriores al dipéptido de abajo para producir dos aminoácidos. Las aminas en los productos se muestran en su forma protonada debido a que esta reacción de hidrólisis se realizó en condiciones ácidas.

Reducción de Amidas en Aaminas
Las amidas se pueden convertir en aminas de 1°, 2° o 3° usando LiAlH 4 seguido de un tratamiento acuoso. Los grupos alquilo unidos al nitrógeno de la amida no afectan la reacción. La clasificación de amina se correlaciona con la amida como se muestra en el resumen de reacciones a continuación.

Las reducciones de propanamida y N, N-dimetilpropanamida se muestran como ejemplos.
Ejemplo: Reducciones de amida
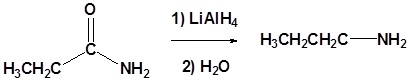

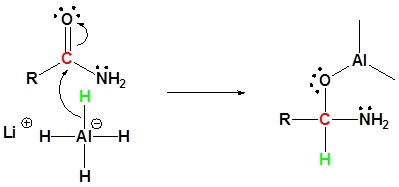
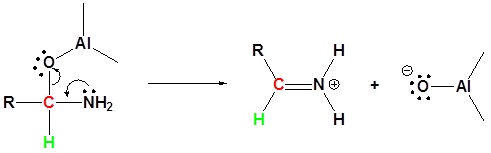
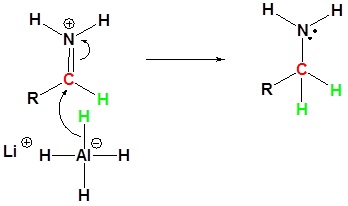
El mecanismo comienza con hidruro nucleofílico que reacciona con el carbono carbonilo para producir el intermedio tetraédrico. Una imine se forma en concierto con la pérdida en el grupo de salida. Un segundo nucleófilo hidruro reacciona con el carbono imina para producir el producto final.
1) Reacción nucleofílica por el hidruro
2) Formación de imina con pérdida de grupo de salida
3) Reacción nucleofílica por el hidruro
Ejercicio
11. ¿Cómo prepararías los siguientes compuestos a partir de N-propilbenzamida?
(a)
b)
c)
12.
Proponer una síntesis para lo siguiente.

- Contestar
-
11.
a) NaOH, H 2 O
b) NaOH, H 2 O, luego LiAlH 4
c) LiAlH 4
12.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Jim Clark (Chemguide.co.uk)

