22.8: Química del Nitrilo
- Page ID
- 76574
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Interesante Nitrilos
Una de las ocurrencias más comunes de nitrilos es el caucho de nitrilo. El caucho de nitrilo es un copolímero sintético de acrilonitrilo y butadieno. Esta forma de caucho es altamente resistente a los productos químicos y se utiliza para fabricar guantes protectores, mangueras y sellos.




Síntesis de Nitrilos
Los nitrilos se pueden sintetizar a partir de la reacción de cianuro nucleofílico con grupos electrófilos, como los carbonilos (aldehídos y cetonas) y los halogenuros de alquilo que son adecuados para reacciones de S N 2. Las amidas pueden reaccionar con cloruro de tionilo para producir nitrilos.
La adición de cianuro (-:C≡ N) a un aldehído o cetona forma una cianhidrina.

Los nitrilos se forman por una reacción de S N 2 entre un bromuro de alquilo y cianuro de sodio

Las amidas primarias (1 o) pueden convertirse en nitrilos por deshidratación con cloruro de tionilo (u otros agentes deshidratantes como P 2 O 5, o POCl 3).
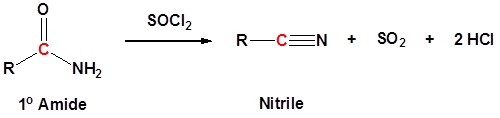
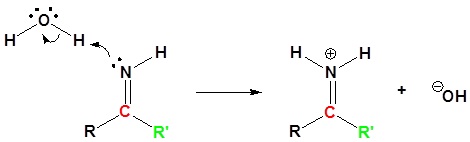
Para la reacción de amidas primarias con cloruro de tionilo, el mecanismo comienza con el par solitario del átomo de nitrógeno formando una imina protonada y empujando los electrones pi del carbonilo para formar un enlace sigma con el azufre del cloruro de tionilo. Las reformas del enlace sulfonilo en concierto con la pérdida del grupo saliente (Cl -). La imina protonada es neutralizada por cualquier base. El nitrilo es producido por una última reacción de desprotonación con una pérdida de dióxido de azufre y cloruro como grupos salientes.
A continuación se muestra el mecanismo completo.
1) Formación de imina protonada con reacción nucleofílica del enlace carbonilo pi
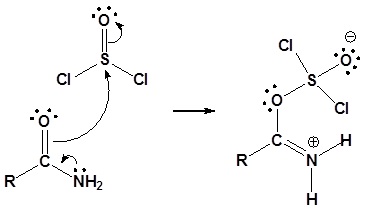
2) Dejando la eliminación del grupo

3) Desprotonación

4) Desprotonación y retiro del grupo que abandona
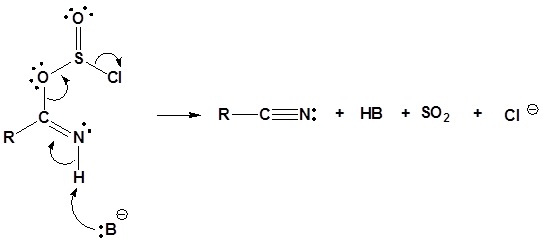
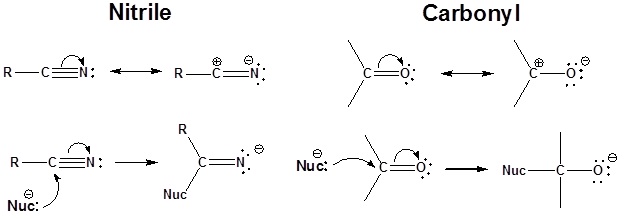
Reactividad de Nitrilos
El carbono en un nitrilo es electrófilo porque se puede dibujar una estructura de resonancia que le coloca una carga positiva. Debido a esto, el triple enlace de un nitrilo acepta un nucleófilo de una manera similar a un carbonilo.
Los nitrilos se pueden convertir en ácido carboxílico con calentamiento en ácido sulfúrico. Durante la reacción se forma un intermedio amida.

La hidrólisis del ciclopentanocarbonitrilo se muestra a continuación como ejemplo.
Ejemplo: Hidrólisis de Nitrilo

Obsérvese que se entiende la presencia de agua.
El mecanismo comienza con la protonación del nitrilo para hacerlo más electrófilo al agua nucleofílica. Una vez que el agua ha reaccionado con el carbono nitrilo, se producen transferencias de protones para producir un intermedio estabilizado por resonancia. El agua actúa como una base débil para desprotonar el carbonilo para formar la amida que se hidroliza al ácido carboxílico.
1) Protonación

2) Reacción nucleofílica por agua

3) Transferencia de protones

4) Resonancia

5) Desprotonación
6) Posterior hidrólisis de la amida mostrada en la sección amida de este capítulo.
Reducción de nitrilo
Los nitrilos se pueden reducir a aminas primarias con hidruro de litio y aluminio seguido de un tratamiento acuoso. Durante esta reacción el nucleófilo hidruro reacciona con el carbono electrófilo en el nitrilo para formar un anión imina. Una vez estabilizada por una complejación ácido-base de Lewis, la sal de imina puede aceptar un segundo hidruro para formar un dianión. El dianión se puede convertir entonces en una amina mediante la adición de agua para neutralizar el ambiente de reacción. A continuación se muestra la reacción general.

La reducción del ciclopentanocarbonitrilo se muestra a continuación como ejemplo.
Ejemplo: Reducción de nitrilo
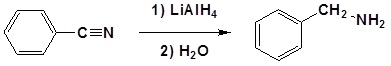
El mecanismo comienza con el hidruro nucleofílico reaccionando con el carbono electrófilo del nitrilo para formar un complejo aniónico de aluminio. Un segundo nucleófilo hidruro reacciona con el mismo carbono electrófilo para formar un complejo tetraédrico. La protonación por adición de agua produce la amina primaria en su forma neutra.
1) Reacción nucleofílica por el hidruro
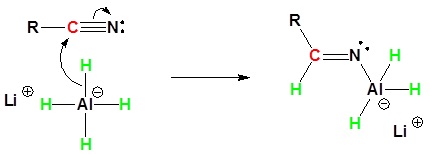
2) Segunda reacción nucleofílica por el hidruro.
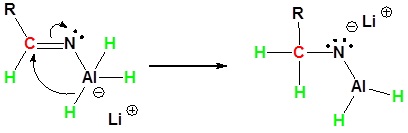
3) Protonación por adición de agua para dar una amina

Reacción organometálica con nitrilos
Los reactivos de Grignard pueden reaccionar con nitrilos para formar una sal de imina que puede hidrolizarse para formar una cetona como se muestra en la reacción a continuación.

La reacción del benzonitrilo con el reactivo de metil-Grignard para formar acetofenona se muestra a continuación como ejemplo.
Ejemplo: Reacción de nitrilo con un reactivo de Grignard

El mecanismo comienza con el reactivo nucleofílico de Grignard reaccionando con el carbono electrófilo del nitrilo para formar una sal de imina. La sal de imina se hidroliza para producir una cetona a través de una serie de reacciones nucleofílicas y de transferencia de protones. El mecanismo completo se muestra a continuación para aquellos que son curiosos.
1) Reacción nucleofílica por el reactivo de Grignard
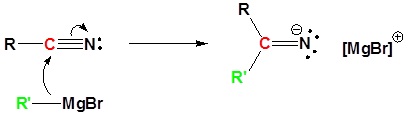
2) Protonación

3) Protonación
4) Reacción nucleofílica por agua

5) Transferencia de protones

6) Dejando la eliminación del grupo

7) Desprotonación

Ejercicio
13. Proponer dos rutas sintéticas diferentes para convertir el bromuro de bencilo en ácido 2-fenilacético.
- Contestar
-
13.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

