22.12: Reacciones Biológicas de Acilación
- Page ID
- 76585
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Glutamina sintetasa
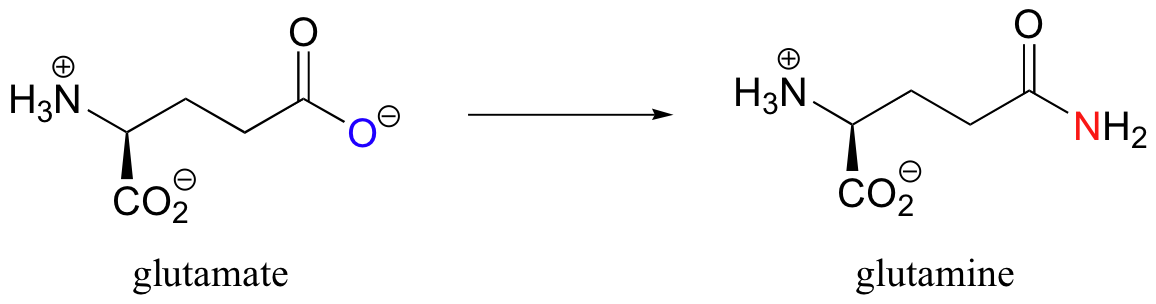
El grupo funcional carboxilato es un sustrato muy poco reactivo para reacciones de sustitución de acilo catalizadas por enzimas. ¿Cómo, entonces, un sistema vivo logra una reacción 'cuesta arriba' como la que se muestra a continuación, donde el glutamato (un carboxilato) se convierte en glutamina (una amida)?
Resulta que esta conversión no se realiza directamente. Más bien, la primera conversión es de un carboxilato (el sustrato de transferencia de acilo menos reactivo) a un fosfato de acilo (el sustrato de transferencia de acilo más reactivo). Esta transformación requiere una reacción con la que estamos familiarizados del capítulo 10: fosforilación de un carboxilato de oxígeno con ATP como donante de fosfato.

Tenga en cuenta que esta es solo una de las muchas formas en que el ATP se usa como unidad de almacenamiento de energía: para hacer una molécula de fosfato de acilo de alta energía a partir de un carboxilato de baja energía, la célula debe 'gastar' la energía de una molécula de ATP.
La versión de fosfato de acilo del glutamato ya está lista para convertirse directamente en una amida (glutamina) a través de una reacción de sustitución de acilo nucleofílica, ya que una molécula de amoníaco ataca al carbonilo y el fosfato es expulsado.

En general, esta reacción se puede escribir como:

Asparagina sintetasa
Otra forma común de grupo carboxilato activado es un fosfato de acil adenosina. Considera otra reacción de aminoácidos, la conversión de aspartato en asparagina. En la primera etapa, se debe activar el grupo carboxilato del aspartato:
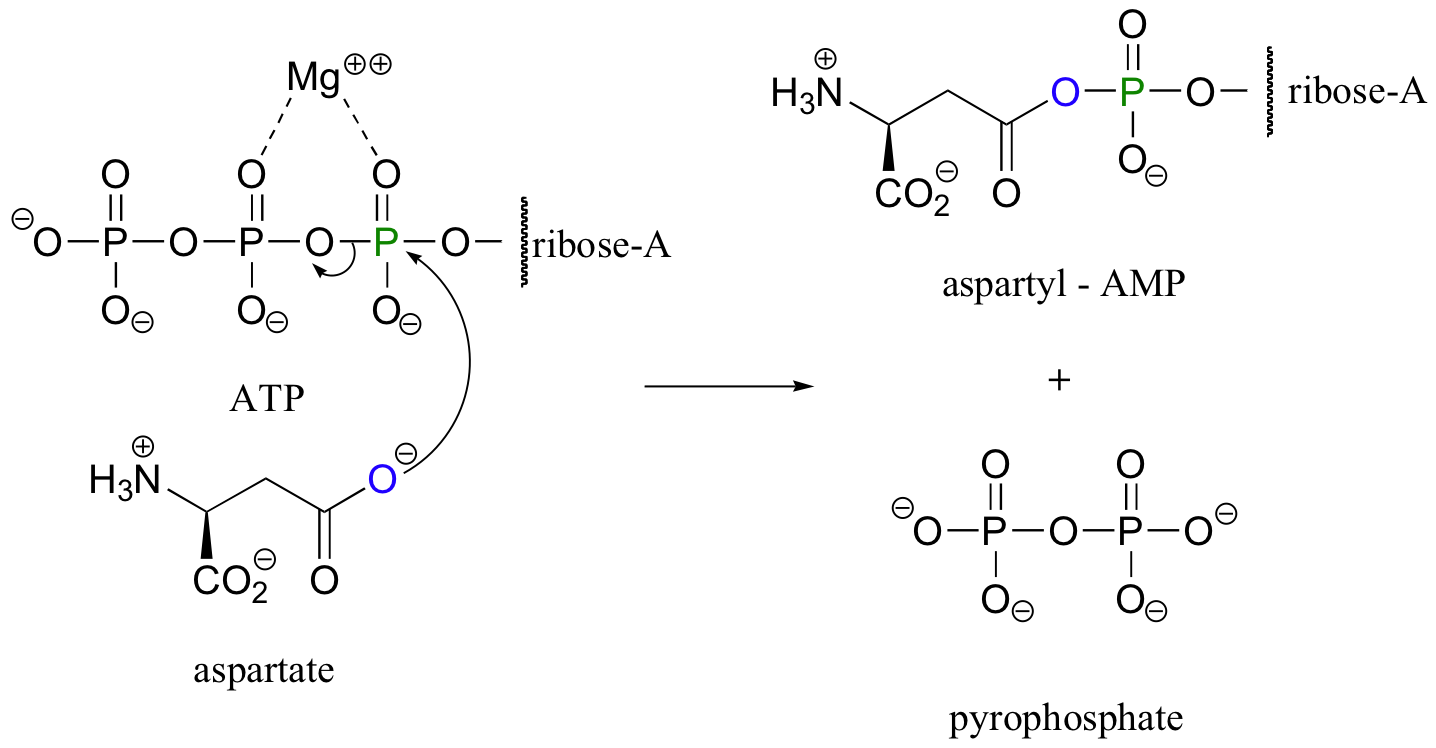
Una vez más, el ATP proporciona la energía para impulsar la reacción cuesta arriba. Esta vez, sin embargo, el carboxilato activado toma la forma de un (mono) fosfato de acil adenosina. Todo lo que ha ocurrido es que el oxígeno carboxilato ha atacado el a-fosfato de ATP en lugar del g-fosfato.
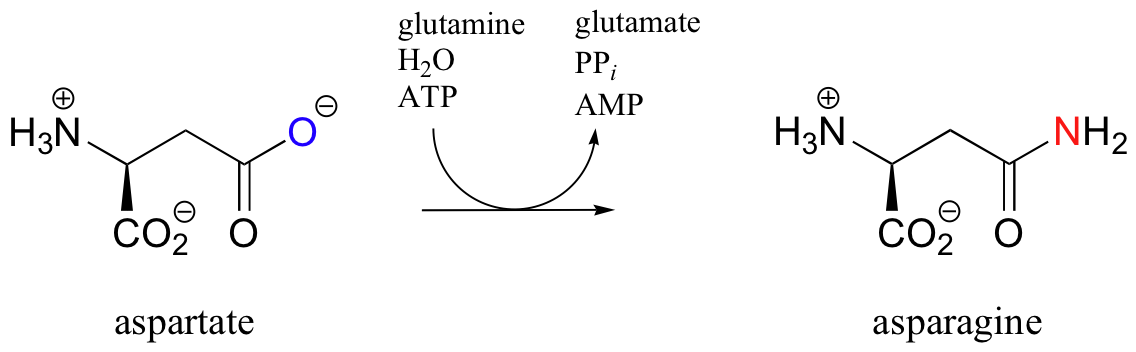
La versión reactiva acil-AMP del aspartato ya está lista para ser convertida en una amida (asparagina) a través del ataque nucleofílico por amoníaco. En el caso de la glutamina sintasa, la fuente de amoniaco fue ion amonio libre en solución. En el caso de la asparagina sintasa, el NH 3 se deriva de la hidrólisis de glutamina (esto es simplemente otra reacción de sustitución de acilo):

La reacción de hidrólisis está ocurriendo en el mismo sitio activo de la enzima —ya que el NH 3 es expulsado en la hidrólisis de glutamina, inmediatamente da la vuelta y actúa como nucleófilo en la conversión de aspartil-AMP en asparagina:

Tenga en cuenta que la misma enzima también se está uniendo al ATP y usándolo para activar el aspartato, ¡esta es una zona de construcción ocupada!
En general, esta reacción se puede escribir en forma condensada como:
El uso de glutamina como 'portador' del amoníaco es una estrategia bastante común en las vías metabólicas. Esta estrategia tiene sentido, ya que permite a las células mantener una fuente constante de NH 3 para las reacciones que lo requieran, sin necesidad de altas concentraciones de solución de amoníaco libre.
Glicinamida ribonucleótido sintetasa
Uno de los primeros pasos en la construcción de bases purinas (las bases de adenina y guanina en ADN y ARN) implica una reacción de sustitución de acilo con un intermedio de fosfato de acilo. En este caso, el nucleófilo atacante no es el amoníaco sino una amina primaria. La estrategia, sin embargo, es similar a la de la glutamina sintasa. El grupo carboxilato en la glicina se convierte en un fosfato de acilo, a costa de una molécula de ATP. El grupo acilo se transfiere luego a 5-fosforribosilamina, dando como resultado un producto amida.