1.2: Dirección de la reacción ácido-base y posición de equilibrio
- Page ID
- 76860
Las reacciones ácido-base comienzan debido a interacciones electrostáticas, pero el grado en que avanza la reacción depende de la energía libre relativa de Gibbs de los reactivos y productos, es decir, el cambio general de energía libre de Gibbs (\(\Delta \mathrm{G}\)) para la reacción. Este es un punto sutil pero importante: la reacción no ocurre porque los productos son más estables, ocurre porque hay una fuerza atractiva entre dos reactivos que tienen estructuras polares, Como veremos, podemos predecir las cantidades relativas de reactivos y productos en una mezcla (a equilibrio), basado tanto en una comprensión de las estructuras moleculares como en la comparación de sus\(\mathrm{pK}_{\mathrm{a}}\).
Resistencia a los ácidos (usando el modelo Brønsted — Lowry):
La fuerza de un ácido, es decir el grado en que dona\(\mathrm{H}^{+}\) a (o acepta pares de electrones de) otras moléculas, depende de una serie de factores que incluyen, obviamente, la fuerza de la base (es decir, el grado en que la base dona pares de electrones a otras moléculas) con la que reacciona. Las resistencias de ácido y base generalmente se reportan usando agua como disolvente (es decir, como base o ácido respectivamente), de manera que las fuerzas ácidas se pueden comparar directamente. Dado que las reacciones biológicas tienen lugar en solución acuosa, podremos ampliar nuestra comprensión de las reacciones ácido-base simples a otras mucho más complejas a medida que avancemos.
La reacción para cualquier AH ácido es:\[\mathrm{HA}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{A}^{-}\]
Podemos estimar el alcance de la reacción (es decir, hasta dónde llega la reacción, es decir, las concentraciones de reactivos y productos cuando la reacción alcanza el equilibrio) determinando la constante de equilibrio\(\mathrm{K}_{\mathrm{a}}\). \[\mathrm{K}_{\mathrm{a}}=\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\left[\mathrm{A}^{-}\right] /[\mathrm{HA}]\]
A diferencia de los ácidos inorgánicos fuertes (como\(\mathrm{HCl}\), o\(\mathrm{HNO}_{3}\)), las constantes de equilibrio para muchos ácidos orgánicos son pequeñas (que van de 10 —1 a 10 -55) y es más común informar\(\mathrm{pK}_{\mathrm{a}}\) —que, como recordarán, lo es\(=-\log \mathbf{K}_{\mathbf{a}}\). Un ácido fuerte como\(\mathrm{HCl}\) tiene un gran\(\mathrm{K}_{\mathrm{a}}\) (de hecho es tan grande que no tiene sentido) y por lo tanto un muy pequeño (negativo)\(\mathrm{pK}_{\mathrm{a}}\).
|
Ácido |
K a |
pK a |
|---|---|---|
|
HCl (ácido clorhídrico) |
~10 7 |
—7 |
|
CF 3 COOH (ácido trifluoroacético) |
3.2 x 10 —1 |
0.5 |
|
HF (ácido fluorhídrico) |
7.2 x 10 —4 |
3.14 |
|
CH 3 COOH (ácido acético) |
1.8 x 10 —5 |
4.8 |
|
H 2 O |
10 -14 |
14 |
|
CH 3 CH 2 OH (ácido acético) |
10 -16 |
16 |
| NH 4 + (amoniaco en NH 4 Cl) | 5.6 x 10 —10 | 9.25 |
| CH4 (metano) | ~10 —55 | 55 |
Ayuda a poder interpretar estos números en términos de la extensión de la reacción asociada. Por ejemplo, el agua (que actúa tanto como ácido como base) se disocia en muy pequeña medida. En un litro de agua pura, que contiene ~54 moles de moléculas de agua (o\(\sim 54 \times 6.02 \times 10^{23}\) moléculas o\(\sim 3.25 \times 10^{25}\) moléculas),\(\sim 10^{-7}\) moles (o\(\sim 10^{-7} \times 54 \times 6.02 \times 10^{23}\) moléculas o\(\sim 3.25 \times 10^{16} \mathrm{H}_{3} \mathrm{O}^{+}\) iones). Cuanto más débil es el ácido más alto es\(\mathrm{pK}_{\mathrm{a}}\) (¿puede explicar por qué es así y qué significa en términos de las concentraciones relativas de especies en equilibrio?).
Te ayudará mucho si memorizas algunos\(\mathrm{pK}_{\mathrm{a}}\) valores aproximados importantes para los ácidos comunes, por ejemplo los alcoholes tienden a tener un\(\mathrm{pK}_{\mathrm{a}}\) de\(\sim 15\), mientras que las aminas tienen un\(\mathrm{pK}_{\mathrm{a}} \sim 33\). Como veremos el\(\mathrm{pK}_{\mathrm{a}}\) de diversas especies de carbono es muy dependiente del ambiente del\(\mathrm{C-H}\) enlace, pero recordar que los enlaces\(\mathrm{sp}^{3}\) carbono-hidrógeno (\(\mathrm{pK}_{\mathrm{a}} \sim 55\)) no es probable que se ionicen bajo ninguna circunstancia es útil. Sin embargo, es aún más importante comprender los factores que afectan la fuerza ácida, y poder utilizarlos para predecir y explicar los resultados de las reacciones.
Otra idea importante a recordar es que la extensión de una reacción (medida por su constante de equilibrio\(K\)) está relacionada con el cambio en la energía libre de Gibbs (\(\Delta \mathrm{G}^{\circ}=\Delta \mathrm{H}^{\circ}-\mathrm{T} \Delta \mathrm{S}^{\circ}\)) asociada a esa reacción. Es decir, cuando pensamos en el alcance de una reacción (la concentración de reactivos y productos cuando la reacción alcanza el equilibrio) en términos de las estabilidades relativas de los reactivos y productos necesitamos tener en cuenta tanto el cambio de entalpía (\(\mathrm{H}^{\circ}\)), que refleja los cambios en la unión y interacciones intermoleculares que involucran tanto reactivos como productos, y el cambio de entropía (\(\Delta \mathrm{S}^{\circ}\)) asociado con el sistema de reacción. Recordemos que\(\Delta \mathrm{S}^{\circ}\) refleja el cambio en el número de posibles estados energéticos y posiciones en el sistema de reacción. Para la mayoría de los ácidos orgánicos (débiles) resulta que el\(\mathrm{H}^{\circ}\) de la reacción de disociación en agua es aproximadamente cero, debido a que los tipos de enlaces e interacciones que se rompen y se forman durante la reacción son similares. Las diferencias en\(\Delta \mathrm{G}\) la reacción (y por lo tanto\(\mathrm{K}_{\mathrm{a}}\) y\(\mathrm{pK}_{\mathrm{a}}\)) se deben típicamente a diferencias en\(\Delta \mathrm{S}\).
Preguntas para responder
- Explique por qué los ácidos y las bases siempre se encuentran (como pares) juntos en un sistema.
- ¿Qué se entiende por los términos ácido conjugado o base conjugada?
- En el modelo de Lewis para la reacción de\(\mathrm{HCl}\) + agua, explica por qué dibujas la flecha apuntando de\(\mathrm{O}\) a\(\mathrm{H}\).
- Completar estas reacciones ácido-base y predecir las cantidades relativas de reactivos y productos cuando la reacción alcanza el equilibrio para cada reacción. Explica tus predicciones usando tu conocimiento de estructuras atómicas y moleculares y electronegatividad. \ [\ begin {alineado}
&\ mathrm {CH} _ {3}\ mathrm {NH} _ {2} +\ mathrm {HCL}\ rightleftarrows\\
&\ mathrm {CH} _ {3}\ mathrm {NH} _ {2} +\ mathrm {H} _ {2}\ mathrm {O}\ rightleftarrows\\
&\ mathrm {CH} _ {3}\ mathrm {NH} ^ {-} +\ mathrm {H} _ {2}\ mathrm {O}\ derechaizquierdas\\
&\ mathrm {CH} _ {3}\ mathrm {NH} _ {3} ^ {+} +\ mathrm {H} _ {2}\ mathrm {O}\ rightleftarrows
\ end {alineado}\]
Ácidos y Bases Orgánicos
Habiendo revisado ácidos y bases usando moléculas bastante simples (\(\mathrm{HCl}\)y\(\mathrm{NH}_{3}\)), pasemos al mundo más complejo de los ácidos y bases orgánicos, cómo identificarlos, cómo determinar las fortalezas relativas y cómo predecir lo que sucederá en cualquier mezcla dada. Comenzamos comparando los\(\mathrm{pK}_{\mathrm{a}}\)'s de algunos ácidos orgánicos. Empecemos por el etanol (\(\mathrm{pK}_{\mathrm{a}} \sim 16\)), una molécula que normalmente no consideramos un ácido, y el ácido acético (\(\mathrm{pK}_{\mathrm{a }} 4.8\)). Claramente hay una gran diferencia entre los\(\mathrm{pK}_{\mathrm{a}}\)'s de estas dos moléculas, la pregunta es ¿podemos entender por qué es así?
Si sacamos sus estructuras vemos que ambos tienen (como se esperaba) el hidrógeno ácido unido al oxígeno electronegativo. (Asegúrese de recordar por qué los hidrógenos unidos a los carbonos no son tan ácidos como los unidos al oxígeno). Entonces, ¿por qué la gran diferencia en\(\mathrm{pK}_{\mathrm{a}}\)'s? Para responder a esta pregunta tenemos que recordar que el alcance de la reacción depende de la estabilidad termodinámica relativa de los productos, es decir, del sistema que contiene la base conjugada del ácido y el ion hidronio. Aquí se muestran las reacciones y bases conjugadas de las dos (\(\downarrow\)). Con base en sus\(\mathrm{pK}_{\mathrm{a}}\) valores, predecimos que la reacción de disociación del etanol es rara (se forman pocos iones etóxido) mientras que la reacción de disociación del ácido acético es más frecuente. Sin embargo, tenga en cuenta que incluso en el caso del ácido acético solo alrededor del 3% de las moléculas de ácido se disocian en una solución 1M.
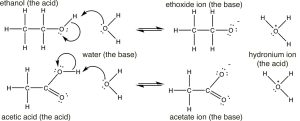
El primer paso en ambas reacciones parece ser más o menos el mismo, un par de electrones del oxígeno en el agua forma un enlace al hidrógeno deficiente en electrones mientras que el\(\mathrm{O-H}\) enlace del ácido se rompe y los electrones originalmente asociados con él vuelven al oxígeno. La diferencia entre las dos reacciones radica principalmente en la forma en que se comportan las bases conjugadas cargadas negativamente (etóxido y acetato), y la forma en que son solvatadas por el disolvente (agua). Para el etóxido (base conjugada de etanol), la carga extra negativa se localiza en el oxígeno, lo que conduce a una concentración de carga. Las moléculas de agua son fuertemente atraídas por el anión etóxido, una interacción que limita la movilidad de las moléculas de agua híbridas de resonancia de estructuras de resonancia y da como resultado una disminución de la entropía (\(\Delta \mathrm{S}\)es negativa). Por el contrario, en el acetato (base conjugada del ácido acético), la carga negativa se deslocaliza en ambos oxígenos (aunque a menudo se dibuja como si estuviera asociada con uno pero no con el otro). Podemos ilustrar esto de dos maneras (¡o más!) dibujando flechas para indicar cómo el par de electrones extra puede moverse de un oxígeno a otro; se ve así (\(\rightarrow\)).
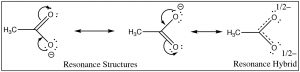
La estructura real tiene una carga negativa parcial en ambos oxígenos. Este par de estructuras a menudo se conoce como una estructura de resonancia y el proceso se denomina resonancia pero el nombre es engañoso. De hecho, la estructura real, el híbrido de resonancia, NO implica que los electrones (y el doble enlace) se muevan de un lado a otro entre los dos átomos de oxígeno. Por una analogía biológica (y no completamente sensata) podríamos decir que es una mula o un hinny —la descendencia de un cruce entre un caballo y un burro. [6] Así como una mula (o un hinny) no está rebotando de un lado a otro entre ser un caballo y ser un burro, entonces el híbrido de resonancia realmente existe como una nueva especie [7], con una estructura real que se encuentra a medio camino entre las dos estructuras de resonancia (dibujadas). En este caso, estamos utilizando dos modelos de unión (un enlace de valencia y un modelo orbital molecular deslocalizado) para describir la estructura del anión acetato. El modelo de enlace de valencia localizada implica un marco de enlace sencillo sigma que conecta los átomos y proporciona la forma molecular. El modelo orbital molecular deslocalizado describe un enlace pi que conecta ambos\(\mathrm{O}\) s con el\(\mathrm{C}\). Podemos visualizar el anión como un carbono\(\mathrm{sp}^{2}\) hibridado plano conectado a un grupo metilo y dos oxígenos por enlaces sigma junto con un enlace pi de dos electrones de 3 átomos que se extiende sobre el\(\mathrm{O-C-O}\) marco (\(\rightarrow\)). El resultado es que en el ion acetato la carga negativa se deslocaliza sobre dos oxígenos, en lugar de concentrarse en un solo átomo como está en el ion etóxido. El resultado es que las interacciones del acetato con las moléculas de agua solvente no son tan fuertes, por lo que las moléculas de agua no están tan ordenadas, lo que significa que el agua no está tan ordenada alrededor de la molécula y el cambio de entropía no es tan negativo. Los efectos de la deslocalización de la carga sobre más de un átomo juegan un papel importante en la predicción de los resultados de una amplia gama de reacciones. Observamos que\(\Delta \mathrm{S}\) sigue siendo negativo ya que la creación de una especie cargada aún conduce a un mayor orden de las moléculas solventes.
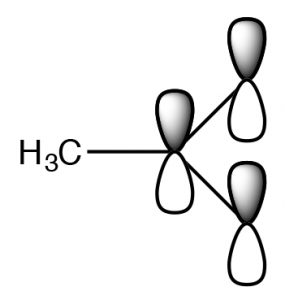
Una forma de predecir si la carga puede deslocalizarse es determinar si se pueden dibujar estructuras de resonancia para las especies cargadas. Por ejemplo: intenta convencerte de que no puedes dibujar estructuras de resonancia para etanol.
La resonancia no es la única forma de estabilizar la carga. Por lo general, la resonancia ocurre a través de un sistema de enlace pi conjugado, tal como ocurre dentro de la\(-\mathrm{CO}_{2}^{-}\) parte de un ácido orgánico, pero ¿cómo se explica la diferencia en las acidedades del ácido acético (\(\mathrm{pK}_{\mathrm{a }} 4.8\)) y el ácido trifluoroacético (\(\rightarrow) (\(\mathrm{pK}_{\mathrm{a }} 0.5\)), a pesar de que ambos tienen el grupo funcional carboxilato? La diferencia entre ambos radica en el hecho de que la carga sobre el anión trifluoroacetato se deslocaliza por dos mecanismos distintos. Al igual que en el acetato, la carga negativa se deslocaliza por resonancia a través del sistema de enlace pi; además también se deslocaliza sobre los fluoros por el hecho de que los átomos de flúor altamente electronegativos (más electronegativos que\(\mathrm{O}\)) retiran electrones del carbono metílico a través de los enlaces sigma, que a su vez retira electrones del siguiente carbono, y a su vez de los dos oxígenos (un proceso conocido como “inducción”). El resultado es que la carga negativa se “mancha” sobre aún más átomos, lo que hace que el anión sea aún menos probable que cause un orden de moléculas solventes (reduciendo el efecto sobre\(\Delta \mathrm{S}\)). Como cabría esperar, el efecto inductivo depende de la distancia (tal vez pueda predecir el efecto de agregar más\(\mathrm{CH}_{2}\) grupos entre los\(\mathrm{CO}_{2}\) grupos\(\mathrm{CF}_{3}\) y).
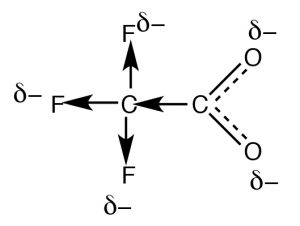
Preguntas a Responder:
- Usando estructuras de resonancia predicen cuál es más ácido:\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{OH}\) o\(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{OH}\)?
- Dibujar estructuras para mostrar cómo el etóxido de sodio y el acetato de sodio se solvatan en agua, y utilízalas para mostrar por qué el cambio de entropía negativo para la formación de acetato de sodio es menor que el del etóxido de sodio.
- Considere los\(\mathrm{pK}_{\mathrm{a}}\)'s de los tres ácidos clorobutanoicos:\(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{CHClCOOH}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 2.86) }\),\(\mathrm{CH}_{3} \mathrm{CHClCH}_{2} \mathrm{COOH}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 4.05) }\), y\(\mathrm{CH}_{2} \mathrm{ClCH}_{2} \mathrm{CH}_{2} \mathrm{COOH}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 4.53) }\). Dibuja estructuras y utilízalas para explicar por qué estos ácidos carboxílicos tienen diferentes\(\mathrm{pK}_{\mathrm{a}}\).
Bases Orgánicas
Como se señaló anteriormente, no hay ácidos sin bases, y viceversa. Incluso si solo estamos discutiendo la transferencia\(\mathrm{H}^{+}\) (protónica), es (posiblemente) más fácil pensar en la base usando un modelo de Lewis. Es decir, una base tiene un par de electrones disponible para su donación en un enlace con el ácido. Recordemos que casi todo lo que tiene un par de electrones no enlazantes (a veces llamado par solitario) puede actuar como base. Los tipos más comunes de bases orgánicas suelen tener un átomo de nitrógeno en algún lugar de su estructura. Si comparamos la basicidad de\(\mathrm{N}\),\(\mathrm{O}\) y\(\mathrm{F}\), cada uno de los cuales tiene pares solitarios que potencialmente podrían ser donados, el nitrógeno es el menos electronegativo y por lo tanto el mejor capaz de donar sus electrones a un enlace, ya que su par solitario es menos atraído por el núcleo. El flúor, el elemento más electronegativo, mantiene sus electrones muy cerca del núcleo, y en circunstancias normales no se consideraría como base.
El oxígeno, ya que es más electronegativo que el nitrógeno no es una base tan fuerte, por lo tanto cuando se mezclan amoníaco y agua, la única reacción que se produce (y que en una medida relativamente pequeña) es una transferencia de protones del agua al amoníaco. \[\mathrm{NH}_{3}+\mathrm{H}_{2} \mathrm{O} \leftrightarrows \mathrm{NH}_{4}^{+}+{ }^{-} \mathrm{OH}\]
La constante de equilibrio para esta reacción es\(1.8 \times 10^{-5}\) (la mayoría de las especies en la mezcla en equilibrio son reactivos)
*insertar imagen aquí*
Aquí hay algunas bases orgánicas (\(\rightarrow\)). Tenga en cuenta que son componentes de una amplia gama de moléculas biológicamente activas, incluyendo ADN, hormonas y productos farmacéuticos. Como veremos el nitrógeno básico proporciona una manera importante de entender la reactividad de una especie en particular.
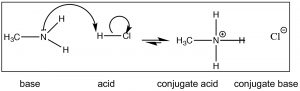
Por ahora, sin embargo, comencemos con una base más simple como la metilamina (\(\mathrm{CH}_{3} \mathrm{NH}_{2}\)) la base orgánica nitrogenada más simple. La metilamina reacciona con los ácidos (\(\downarrow\)) de la misma manera que lo hace el amoníaco; reaccionará con un ácido fuerte como\(\mathrm{HCl}(\mathrm{aq})\) para producir cloruro de metilamonio.
Recordemos que la posición de equilibrio se puede predecir comparando la (s) fuerza (\(\mathrm{pK}_{\mathrm{a}}\)s) de los dos ácidos. \(\mathrm{HCl}\left(\mathrm{pK}_{\mathrm{a}}-7\right)\)es un ácido mucho más fuerte que\(\mathrm{CH}_{3} \mathrm{NH}_{3}{ }^{+}\left(\mathrm{pK}_{\mathrm{a}} \sim 10\right)\) y por lo tanto predecimos que el equilibrio de la\(\mathrm{HCl}\) reacción de metilamina + quedará bien a la derecha. Consideremos ahora la reacción en la que la metilamina reacciona con el ácido acético (\(\downarrow\)).
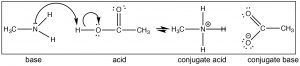
Nuevamente podemos predecir la posición de equilibrio comparando\(\mathrm{pK}_{\mathrm{a}}\)'s de los ácidos conjugados (ácido acético\(4.8\) y\(\mathrm{CH}_{3} \mathrm{NH}_{3}{ }^{+} \sim 10\)). Observe que puede predecir la estructura de los productos simplemente siguiendo el flujo de electrones. Podríamos cambiar los grupos\(\mathrm{CH}_{3}\) (metilo) en la metilamina y el ácido acético a una amplia gama de grupos diferentes y aún así poder predecir el producto fácilmente, siempre y cuando reconozcas que la reacción que tiene lugar es una (simple) transferencia de protones (ácido-base). Por ejemplo, mira la estructura de la cocaína (arriba): ¿puedes predecir qué pasará si reaccionara con ácido acético? ¿Cuál sería la estructura del producto?
Moléculas que contienen tanto un ácido como una base:
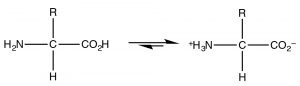
El ejemplo más común de una molécula que actúa tanto como ácido como base es, por supuesto, el agua porque tiene tanto un hidrogeado potencialmente ácido, como un par solitario que puede aceptar el protón. Sin embargo, dado que se trata de la química orgánica, donde el agua no es un disolvente tan común, consideremos la clase de moléculas que tienen dominios tanto ácidos como básicos simultáneamente. Las moléculas más importantes biológicamente son los aminoácidos, que tienen tanto un grupo amino como un ácido carboxílico. Un subconjunto de los posibles aminoácidos son los utilizados en sistemas biológicos para ensamblar polipéptidos. Los aminoácidos (o más bien los\(\alpha\) -aminoácidos) contienen tanto un ácido carboxílico como un grupo amino unido a un carbono central (el\(\alpha\) -carbono). La estructura genérica se da aquí (\(\rightarrow\)) donde R representa una amplia gama de cadenas laterales. [8] En\(\mathrm{pH } 7\) el aminoácido existe en lo que se conoce como una forma zwitteriónica, en la que el grupo ácido carboxílico está cargado negativamente mientras que el grupo amino está cargado positivamente. En ningún momento existiría un aminoácido (disuelto en agua) en una forma no ionizada. Podemos predecir qué forma estaría presente en diferentes\(\mathrm{pH}\)'s considerando las\(\mathrm{pK}_{\mathrm{a}}\) de las especies involucradas.