1.1: Una revisión rápida de los modelos de reacciones ácido-base.
( \newcommand{\kernel}{\mathrm{null}\,}\)
Hay varias formas de discutir las reacciones ácido-base, dependiendo de qué aspectos de la reacción queremos destacar. Van desde el modelo extremadamente simplificado (y no útil) de Arrhenius, hasta el modelo Brønsted—Lowry que utilizamos únicamente para reacciones en las que se transfieren protones, y finalmente hasta el modelo de Lewis, que puede abarcar cualquier tipo de reacción ácido-base.
Arrhenius:
El modelo ácido-base de Arrhenius es probablemente el primer modelo ácido-base que te introdujeron en el curso de tu educación. En este modelo, cuando un ácido se disuelve en agua se disocia para liberar un ion hidrógeno (H +); cuando una base se disuelve libera un ion hidróxido (—OH).
Ácido:HCl(g)+H2O→H+(aq)+Cl−(aq) (a veces escrito como oHCl(aq))
Base:NaOH(s)+H2O→Na+(aq)+−OH(aq)
Reacción Ácido-Base:HCl(aq)+NaOH(aq)→NaCl(aq)+H2O (l) [2]
Aunque simple, el modelo Arrhenius no es particularmente útil a la hora de entender las reacciones consideradas en la química orgánica. Esto por supuesto plantea la pregunta obvia: entonces, ¿por qué la estamos mencionando? La respuesta es doble: i) porque bien podrías recordarlo vagamente como una descripción de los comportamientos ácido-base y ii) para que podamos considerar por qué no es útil y por qué no deberías usarlo. El modelo ácido-base de Arrhenius se aplica solo cuando el agua es el disolvente, ya que veremos que muchas reacciones orgánicas no ocurren en el agua. El modelo Arrhenius también, implica falsamente que hay protones libres (H+) vagando en el agua y restringe bases a aquellas sustancias que liberan un ion hidróxido. Por último, implica que un ácido puede existir independientemente de una base y viceversa, lo que no tiene mucho sentido.
Brønsted—Lowry:
El modelo Brønsted-Lowry es un modelo mucho más útil y flexible para considerar reacciones ácido-base. En este modelo un ácido es un donante de protones (H+) y una base es un aceptor de protones. En el modelo Brønsted—Lowry no se puede tener un ácido sin base, y viceversa; el ácido tiene que donarloH+ a algo (la base), y de manera similar la base tiene que aceptarlo. ElH+ no solo “deja” —se transfiere. [3] En el caso de reacciones que ocurren dentro de solución acuosa, laH+ se transfiere a una molécula de agua para formarH3O+. Consideremos, como ejemplo,HCl; en solución acuosaHCl transferir unH+ grupo a una molécula de agua. Los productos sonH3O+ (el ácido conjugado del agua) yCl−, la base conjugada deHCl.
|
HCl (g) + |
H 2 O (l) |
⇆ |
H 3 O + (aq) |
+ |
Cl — (aq) |
|
ácido |
base |
ácido conjugado |
base conjugada |
|
HCl |
+ |
NH 3 |
NH 4 + + |
Cl — |
|
ácido |
base |
ácido conjugado |
base conjugada |
En el modelo Brønsted—Lowry, como para todas las reacciones químicas consideradas a nivel molecular, existe la posibilidad de que la reacción se revierta, lo que se denota mediante el uso de flechas de equilibrio (⇄).
A nivel macroscópico, el grado en que procede la reacción (desde los reactivos a la izquierda hasta los productos de la derecha) se determina por una serie de factores. Es decir, necesitamos más información para predecir (o calcular) las concentraciones de reactivos y proyectos en equilibrio. Esta es información que también nos permite predecir si la reacción procederá en la dirección hacia adelante (hacia la derecha) o no y cómo podría cambiar la reacción si agregamos o eliminamos reactivos (o productos).
Podemos identificar un potencialmente ácidoH+ porque estará unido a una más electronegativa átomo; el resultado es que la densidad electrónica en el enlace estará principalmente con el átomo más electronegativo (e.g.O,N, oCl). El resultado es que, por ejemplo, unH−O vínculo se debilitará (requerirá menos energía para romperse); elH tendrá una gran carga positiva parcial sobre él, y se sentirá fuertemente atraído por los centros básicos (como se describe en el siguiente apartado). De igual manera, las bases simples pueden identificarse por la presencia de un átomo (dentro de la molécula) que tiene una carga negativa parcial; esta carga negativa parcial surge porque el átomo (el centro básico) está unido a átomos menos electronegativos. Ahora agregamos una consideración más, este átomo central base también necesita poder aceptar el entranteH+. En la práctica, esto significa que una molécula básica contendrá un átomo que tiene un par solitario (sin unión) de electrones que pueden formar un enlace a laH+.
El modelo Brønsted—Lowry es útil para reacciones ácido-base que implican transferencia de protones, pero aún así, se limita a las reacciones de transferencia de protones. También señalamos aquí que el solvente en el que tenga lugar la transferencia de protones tendrá un efecto en la reacción, y volveremos a esta idea más adelante en el curso. Si extendemos el modelo de Brønsted a otras reacciones en las que una base usa su par de electrones solitarios para formar un nuevo enlace con un centro electropositivo, podemos expandir aún más la clase de reacciones ácido-base. Lo que nos lleva al siguiente modelo de química ácido-base: el modelo Lewis.
Lewis:
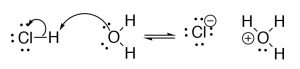
El modelo de Lewis nos permite describir exactamente el mismo conjunto de reacciones que el modelo Brønsted—Lowry, pero desde una perspectiva diferente, y también nos permite ampliar el modelo. En el modelo Lewis una base tiene la capacidad de donar un par de electrones para formar un nuevo enlace con el ácido que acepta este nuevo enlace, muchas veces pero no siempre con la ruptura concomitante de un enlace dentro de la molécula de ácido. Utilizamos la misma razón de por qué ocurre la reacción entre dos centros con carga opuesta, pero desde la perspectiva de los electrones, más que laH+. Por lo tanto, una base debe tener un par solitario de electrones que puedan tomar parte en un enlace mientras que un ácido debe tener un átomo que pueda aceptar ese par solitario de electrones. Usando la reacción deHCl y el agua como ejemplo, usamos la notación de flecha curva para denotar cómo los electrones se mueven entre base y ácido. Recordemos [4] que usamos esta notación de flecha curva para indicar el movimiento del par de electrones

de una fuente de electrones a un sumidero. Aquí la fuente es el par solitario en el oxígeno, y el sumidero es el hidrógeno (que tiene unδ+ debido a su unión a aCl) La segunda flecha se mueve de la fuente (el enlace entreH yCl, al sumidero, el electronegativoCl que termina con la carga negativa, mientras que elO que donó el par de electrones original termina con una carga positiva).
El modelo de Lewis abarca el modelo Brønsted—Lowry, es decir, todas las reacciones ácido-base de Brønsted—Lowry que pueden describirse usando el modelo de Lewis. Sin embargo, el modelo de Lewis extiende el rango de tipos de reacción que pueden considerarse reacciones ácido-base. Tomemos por ejemplo la reacción del amoníaco (NH3) y trifluoruro de boro (BF3). Esta reacción se clasifica como una reacción ácido-base de Lewis, pero no es una reacción ácido-base de Brønsted.
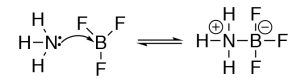
¿Por qué usar diferentes modelos de química ácido-base? Mientras que al principio la idea de usar diferentes modelos para explicar la química ácido-base puede ser un poco confusa. ¿Por qué no usar el modelo Lewis que lo abarca todo para todo? Resulta que tanto los modelos Brønsted—Lowry como Lewis son particularmente útiles dependiendo del sistema que se esté considerando. El truco es reconocer cuál es la más útil a la hora de describir, predecir y explicar un tipo particular de reacción química. [5]
En nuestras exploraciones en química orgánica utilizaremos los modelos Brønsted—Lowry (transferencia de protones) y Lewis (donación de pares de electrones) para describir la química ácido-base, dependiendo del tipo de reacción. En la práctica, el modelo Brønsted—Lowry es simple y útil; te dice lo que está sucediendo (protón transferido del ácido a la base) pero nada sobre el mecanismo por el queH+ se mueve. Para eso debemos recurrir al modelo de Lewis, que nos dice cómo se reordenan los electrones durante la reacción. También es importante tener en cuenta por qué ocurren estas reacciones, son causadas por una interacción electrostática entre dos partes de moléculas con carga opuesta:δ− es atraída porδ+.
Una nota más, todas las reacciones son iniciadas por colisiones aleatorias de moléculas, pero solo son productivas las colisiones que permiten que ocurra la interacción electrostática del ácido y la base (es decir, las colisiones que involucran dos partes de moléculas cargadas de manera similar no darán lugar a una reacción. Nuevamente tendremos más que decir sobre esto más adelante.


