1.3: Efecto del pH sobre las reacciones ácido-base
- Page ID
- 76849
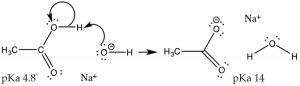
Hasta el momento, hemos discutido situaciones en las que el ácido o base se agrega a solución de agua pura. El agua pura tiene un\(\mathrm{pH}\) de 7, y\(\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]=\left[{ }^{-} \mathrm{OH}\right]\). Ahora consideremos qué sucede cuando cambiamos el\(\mathrm{pH}\) de la solución. Por ejemplo, consideramos una situación en la que disolvemos un simple ácido orgánico (\(\mathrm{CH}_{3}\mathrm{CO}_{2}\mathrm{H}\), ácido acético) en una solución que tiene un\(\mathrm{pH}>7\), es decir donde el\(\left[{ }^{-} \mathrm{OH}\right]>\left[\mathrm{H}_{3} \mathrm{O}^{+}\right]\); bajo estas condiciones se incrementa la extensión de la ionización del ácido acético. Recordemos que en el ácido acético 1M solo\(\sim 3%\) del ácido se ioniza en\(\mathrm{pH } 7\). Si cambiamos la solución para hacerla básica agregando\(\mathrm{NaOH}\), el exceso de base fuerte (\({ }^{-} \mathrm{OH}\)) desprotonará completamente el ácido. En equilibrio, la reacción favorecerá ahora los productos sobre los reactivos (es decir, se moverá hacia la derecha). Lo que hemos hecho aquí es conducir la reacción del\(\leftrightarrows\) acetato de ácido acético hacia la derecha, aumentando la concentración de acetato, que es una aplicación del principio de Le Chatelier). Nótese que\(\mathrm{Na}^{+}\), derivado de la adición de los\(\mathrm{NaOH}\) utilizados para ajustar el\(\mathrm{pH}\), está presente pero no toma parte en la reacción —por esta razón se refirió como un “ion espectador”. Otra forma, quizás más simple, de predecir el resultado de esta reacción es utilizar\(\mathrm{pK}_{\mathrm{a}}\) los valores de los dos ácidos (\(\mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}, 4.8\)y\(\mathrm{H}_{2} \mathrm{O}, 14\)), claramente el ácido acético es un ácido mucho más fuerte que el agua, y por lo tanto la posición de equilibrio para esta reacción se encontrará a la derecha a favor de la el ácido más débil y la base más débil. Lo que hemos hecho aquí es cambiar el ácido acético, que es una molécula orgánica polar, en acetato, una especie iónica.
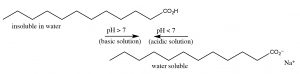
El ácido acético es una molécula orgánica pequeña; ya que es polar puede interactuar con el agua (aunque las fuerzas intermoleculares), por lo tanto el ácido acético es muy soluble en agua (de hecho es miscible con agua (tiene solubilidad ilimitada). [9] Pero ahora, consideremos el efecto de aumentar la longitud del grupo hidrocarbonado del ácido orgánico sobre sus propiedades moleculares. El ácido acético tiene un grupo metilo (\(\mathrm{CH}_{3}-\)), el hidrocarburo más pequeño posible. En contraste, el ácido dodecanoico (láurico) tiene una cadena hidrocarbonada de 12 carbonos (\(\mathrm{CH}_{3}\left[\mathrm{CH}_{2}\right] 11 -\)) y tiene una solubilidad en agua de\(0.063 \mathrm{g} / \mathrm{L}(\sim 30 \mathrm{mM})\) at\(25^{\circ} \mathrm{C}\), que es mucho menor que la del ácido acético. [10] A medida que la parte hidrocarbonada (no polar) de la molécula aumenta de longitud, la solubilidad en agua disminuye: el\(\Delta \mathrm{G}\) proceso de disolución del ácido orgánico en agua se vuelve más positivo. Esta disminución en la solubilidad se debe principalmente a un cambio de entropía negativo (\(\Delta \mathrm{S}\)) causado por la autoorganización de las moléculas de agua alrededor de la “cola” de hidrocarburo de la molécula. Ahora consideremos el comportamiento del dodecanoato de sodio ionizado (la sal sódica del ácido dodecanoico); éste, como muchas especies iónicas, es soluble en agua. Aunque como recordarás, esta es una forma diferente de solubilidad — la especie soluble no son moléculas aisladas sino complejos moleculares conocidos como micelas (\(\rightarrow\)). [11] El resultado de esto es que podemos “solubilizar” los ácidos orgánicos en agua desprotonándolos, pero si luego bajamos el pH, el ácido orgánico se separará de la solución nuevamente.

Las bases orgánicas pueden solubilizarse de manera similar, excepto que ahora la solución debe hacerse ácida. Por ejemplo, una base nitrogenada con un gran grupo no polar como la dodecilamina (\(\mathrm{C}_{12} \mathrm{H}_{27} \mathrm{~N}\)) tiene una solubilidad de aproximadamente\(3.5 \mathrm{~g} / \mathrm{L}(\sim 20 \mathrm{mM})\), pero a\(\mathrm{pH}\) s ácidos es completamente soluble. Contraste la solubilidad de la dodecilamina con la cadaverina (\(\mathrm{NH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{CH}_{2} \mathrm{NH}_{2}\)), el compuesto que huele a su nombre, que es completamente miscible con el agua porque tiene dos grupos amino polares. Resulta que podemos predecir el pH al que un ácido o base particular protonata o desprotonata. Puede recordar de la química general que el pH de los ácidos débiles y sus bases conjugadas (como la mayoría de las especies orgánicas) se puede describir usando la ecuación de Henderson Hasselbalch (\(rightarrow\)).
Una forma de trabajar con esta ecuación es señalar que\([\text { acid }]=\left[\text { conjugate } p H=p K_{a}+\log \frac{[\text { base }]}{[\text { acid }]} \text { base }\right]\) cuando el\(\mathrm{pH}\) del sistema es igual a\(\mathrm{pK}_{\mathrm{a}}\) del ácido. At\(\mathrm{pH}\)'s abajo\(\mathrm{pK}_{\mathrm{a}}\)\(\text { [acid] }>\text { [conjugate base] }\),, hay más ácido que base, y viceversa para\(\mathrm{pH}>\mathrm{pK}_{\mathrm{a}}\). Por lo tanto, ajustando el\(\mathrm{pH}\) podemos cambiar las concentraciones de ácido conjugado y base para que se adapten a nuestros propósitos, o podemos predecir las concentraciones relativas en cualquiera\(\mathrm{pH}\). Por ejemplo, el ácido acético con un\(\mathrm{pK}_{\mathrm{a}}\) de\(4.8\) tendría\(50 \% \mathrm{CH}_{3} \mathrm{CO}_{2} \mathrm{H}\), y\(50 \% \mathrm{CH}_{3} \mathrm{CO}_{2}^{-} \mathrm{Na}^{+}\), a una\(\mathrm{pH}\) de\(4.8\). Si las\(\mathrm{pH}\) caídas por debajo de\(4.8\) la concentración de ácido protonado aumentarán, y si sube la concentración de ion acetato aumentará.
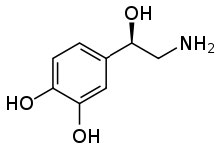
Esta capacidad para transformar una sustancia orgánica de una molécula insoluble (en agua) a una especie iónica soluble puede ser muy útil. Un ejemplo común surge del hecho de que muchos fármacos farmacéuticos son sustancias orgánicas que son insolubles en soluciones acuosas (como citoplasma o sangre). Si estas sustancias se introdujeran en el cuerpo en su forma no ionizada no se disolverían, y por lo tanto estarían inactivas. Si revisas las etiquetas de muchos frascos recetados verás que el medicamento se administra como una sal. Considera la norepinefrina (\ (fila derecha), una hormona que a menudo se administra por vía intravenosa para contrarrestar los efectos de las reacciones alérgicas. Se administra como una sal de ácido tartárico para asegurar que sea soluble en el torrente sanguíneo.
Puede encontrarse con otro ejemplo de este fenómeno (que los ácidos son solubles en solución básica, y las bases son solubles en solución ácida) si toma el curso de laboratorio de química orgánica. Si tu producto tiene un resto ácido o básico en su estructura, puedes extraer la sustancia en solución acuosa (ácida o básica), lavando todos los subproductos orgánicos con un disolvente orgánico, y luego regenerando la sustancia ácida o básica. Este es un método de purificación importante para muchas sustancias, ya que permite que el compuesto de interés se separe en solución acuosa y luego se regenere simplemente agregando o restando un protón.
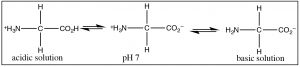
Cuando consideramos biomoléculas (es decir, moléculas orgánicas que se encuentran en los organismos) la situación no es tan clara; la mayoría de las biomoléculas tienen una variedad de grupos ácidos y básicos como parte de su estructura. Incluso el aminoácido más simple, glicina (\(rightarrow\)) existen en una variedad de formas protonadas y desprotonadas dependiendo de la\(\mathrm{pH}\).
Una cosa que queda clara es que los aminoácidos individuales siempre están cargados independientemente del\(\mathrm{pH}\), por lo que son solubles en agua. Pero el alcance de las reacciones de protonación/desprotonación es\(\mathrm{pH}\) dependiente. Como veremos esto tiene una serie de ramificaciones para una amplia gama de moléculas biológicas, ya que se comportarán de manera muy diferente en diferentes soluciones de pH. Esta es una razón importante por la que la mayoría de los sistemas biológicos están tamponados para que permanezcan en una constante bastante\(\mathrm{pH}\).
Preguntas a Responder:
- Si tiene una mezcla de ácido benzoico\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{CO}_{2} \mathrm{H}\left(\mathrm{pK}_{\mathrm{a}}\right. \text { 4.2) }\), tolueno\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{CH}_{3}\) y clorhidrato de anilina (\(\mathrm{pK}_{\mathrm{a}}\)de\(\mathrm{C}_{6} \mathrm{H}_{5} \mathrm{NH}_{3}{ }^{+} 4.6\)). ¿Qué sustancia será soluble en solución ácida acuosa, cuál será soluble en solución básica acuosa, que no será soluble en agua?
- Esbozar un esquema para separar estas tres sustancias mediante el uso de sus diferentes solubilidades en soluciones orgánicas y acuosas de diferentes\(\mathrm{pH}\) s.


