5.3: Reducción de Alquenos-
- Page ID
- 76968
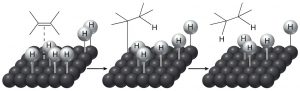
El significado histórico de “reducción” involucró reacciones con hidrógeno (\(\mathrm{H}_{2}\)), y a la inversa, oxidación significó reacción con oxígeno (\(\mathrm{O}_{2}\)). Esto tiene sentido desde la perspectiva de que el carbono es un poco más electronegativo que el hidrógeno, de manera que un\(\mathrm{C-H}\) enlace se polariza como\(\mathrm{C}^{\partial-}\) y\(\mathrm{H}^{\partial+}\). Por lo tanto, agregar hidrógeno a una\(\mathrm{C=H}\) aumentará (ligeramente) la carga negativa sobre el carbono. (De igual manera, un\(\mathrm{C-O}\) enlace se polariza\(\mathrm{C}^{\partial+}\) y\(\mathrm{O}^{\partial-}\), de manera que agregar más oxígenos a un carbono aumenta la cantidad de carga positiva sobre el carbono). Incluso hoy nos referimos a agregar hidrógeno a través de enlaces pi como una reducción. Sin embargo, los alquenos normalmente no reaccionan con hidrógeno; típicamente es necesario un catalizador (generalmente un metal de transición) para que ocurra la reacción. En general, el catalizador se suministra como un polvo finamente dividido adsorbido sobre una sustancia inerte como el carbón vegetal. Los catalizadores más comunes son platino o paladio sobre carbón (\(\mathrm{Pt} / \mathrm{C}\)o\(\mathrm{Pt} / \mathrm{C}\)). Típicamente, la sustancia a reducir se disuelve en un disolvente, se agrega el catalizador y luego se burbujea hidrógeno a través de la mezcla. El catalizador adsorbe ambos\(\mathrm{H}_{2}\) y el alqueno sobre su superficie y esta interacción debilita tanto el\(\mathrm{H}_{2}\) enlace como el enlace pi. Luego, el hidrógeno migra al alqueno adsorbido y se agrega a través del doble enlace. La reacción es estereoespecífica ya que ambos H se suman desde el mismo lado, una adición sin. Esto se puede ver más claramente si usamos deuterio en lugar de hidrógeno, ambos agregan desde el mismo lado.\(\mathrm{D}\)