5.2: Adición “Anti-Markovnikov” a través de los dobles bonos
( \newcommand{\kernel}{\mathrm{null}\,}\)
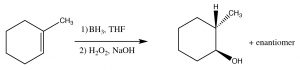
Si bien el encabezamiento de esta sección se llama adición “anti-Markovnikov”, esto no significa que el mecanismo de reacción sea realmente diferente. En los dos ejemplos que discutiremos aquí, la diferencia es meramente que la primera adición al doble enlace no es la H, lo que como veremos hace parecer que hemos agregado un reactivo particular de manera opuesta a la adición normal. Por ejemplo, si queremos agregar agua a través del doble enlace para dar al producto anti-Markovnikov se usa un conjunto diferente de reactivos: un complejo ácido-base de LewisBH3 y el éter tetrahidrofurano (THF), seguido de una solución de peróxido de hidrógeno en base. Este reactivo se suma a través del doble enlace en la dirección que cabría esperar, es decir, el electrófilo (ácido de Lewis) el boro se suma al carbono menos sustituido, pero al mismo tiempo, un hidrógeno se suma al carbono más sustituido desde el mismo lado de la molécula.
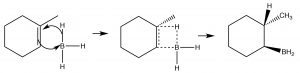
Mecanismo de adición de synBH3 a través del doble enlace
Este proceso ocurre dos veces más, y luego la especie de boro es reemplazada por reacción con peróxido de hidrógeno e hidróxido de sodio.
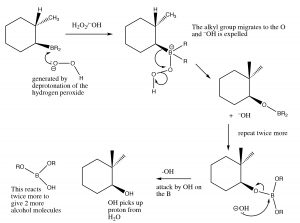
Mecanismo de eliminación del radical boro del doble enlace
La reacción general parece haber agregado los elementos de agua en una dirección anti-Markovinkov. Esta reacción no sólo es regioespecífica, sino que también es estereoespecífica. OHLosH y se agregan en el mismo lado (cis) del doble enlace y se denomina adición sin.
Adición anti-Markovnikov deHBr a través de un doble enlace.
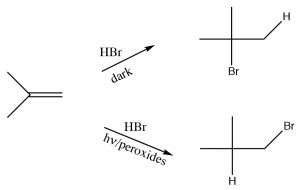
Otra reacción que parece violar lo que hemos aprendido sobre la regioquímica de adición a través de dobles enlaces es la reacción de un alquenoHBr en presencia de luz o peróxidos. En contraste con la reacción discutimos previamente, bajo condiciones de luz y en presencia de peróxidos, lasHBr adiciones en sentido inverso. Claramente algo diferente está sucediendo aquí: la reacción avanza por otroBr mecanismo. La clave es la presencia de peróxidos, lo que casi siempre significa que una reacción avanza a través de un mecanismo radical en lugar de un mecanismo polar.
Los radicales son especies con electrones desapareados y, como tales, son muy reactivos. La reacción comienza con una etapa de iniciación en la que el peróxido (que contiene un\mathrm{O–O} enlace débil) se rompe homolíticamente para dar dos radicales de oxígeno. Estos reaccionan con\mathrm{HBr} abstrayendo un hidrógeno, y dejando un radical bromo. Nótese que el radical oxi abstrae\mathrm{H} y no\mathrm{Br}, porque\mathrm{Br} es un radical más estable que\mathrm{H}. El radical bromo es una especie polarizable grande y que puede ayudar a estabilizar el electrón desapareado. Un radical hidrógeno es en realidad un átomo de hidrógeno, es altamente inestable y reactivo.
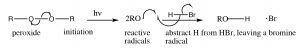
Nota: cuando un mecanismo implica el movimiento de electrones simples (como en una escisión de enlaces homolíticos, o cualquier reacción de una especie radical) usamos lo que se llama una flecha de anzuelo, con una sola cabeza, en lugar de la flecha típica que denota movimiento de dos electrones.

El radical bromo resultante reacciona ahora con el doble enlace alqueno para producir el intermedio más estable, que es (al igual que en los carbocationes) el terciario. Los radicales de carbono muestran las mismas tendencias en estabilidad que los carbocationes por el hecho de que también son deficientes en electrones y pueden estabilizarse por los mismos mecanismos que los carbocationes (inducción e hiperconjugación). El radical de carbono resultante ahora extrae una H de otra molécula de HBr, para producir el producto de adición anti-Markovnikov, más otro radical bromo que puede comenzar el ciclo nuevamente. Esto se llama reacción radical en cadena, porque produce otra especie reactiva que puede continuar con la reacción en cadena.
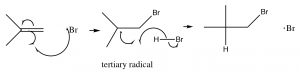
Nota: Aunque esta reacción produce un producto de adición diferente a la adición típica de\mathrm{HBr} a través del doble enlace, los principios que guían la reacción son los mismos. La primera adición produce el intermedio más estable; la diferencia es que el bromo agrega primero.


