6.6: Preparación de Alcoholes
- Page ID
- 77002
Ya hemos visto varios métodos por los cuales se pueden producir alcoholes, la mayoría en Capítulo\(5\). Por ejemplo, la adición de agua a través de un doble enlace, ya sea a través de catálisis ácida (adición de Markovnikov) o por hidroboración/oxidación (adición Anti-Markovnikov), produce alcoholes. También hemos visto, bajo ciertas condiciones, que los alcoholes pueden producirse por sustitución nucleofílica. \(\mathrm{S}_{\mathrm{N}} 1\)Tanto como\(\mathrm{S}_{\mathrm{N}} 2\) las reacciones pueden producir alcoholes, y ahora sería un buen momento para revisar todas estas reacciones (cubiertas en Capítulos\(1\),\(3\),\(4\) y\(5\)).
Una reacción que aún no hemos encontrado es la reducción de compuestos carbonílicos. Por ejemplo, una cetona como la acetona se puede reducir a través de una reacción con borohidruro de sodio (\(\mathrm{NaBH}_{4}\)) o hidruro de litio y aluminio (\(\mathrm{LiAlH}_{4}\)) [7]; ambas moléculas pueden suministrar hidruro (\(\mathrm{H}^{-}\)) al carbono parcialmente positivo del carbonilo.
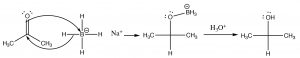
El borohidruro de sodio (\(\mathrm{NaBH}_{4}\)) es generalmente el reactivo de elección ya que es menos reactivo y la reacción puede llevarse a cabo en un matraz abierto, mientras que\(\mathrm{LiAlH}_{4}\) normalmente debe usarse con disolventes que no contengan agua y bajo una atmósfera seca. El\(\mathrm{R-O-BH}_{3}\) complejo intermedio se destruye añadiendo ácido acuoso para dar el producto alcohólico final.
Las reacciones en las que se suministra hidruro a un carbonilo son similares a una reacción que se encuentra en sistemas biológicos. \(\mathrm{NADH}\)(Nicotinamida Adenina Dinucleótido hidruro) es un intermedio inestable generado a través de una serie de procesos metabólicos (como la fermentación), aunque no es tan reactivo como\(\mathrm{NaBH}_{4}\), y (como, esencialmente, todas las reacciones biológicas) requiere un catalizador (una enzima) para lograr la reducción de carbonilos; pero el mecanismo es similar. La reacción (como todas las reacciones) también es reversible, de modo que la versión oxidada de\(\mathrm{NADH}\)\(\mathrm{NAD}^{+}\),, puede aceptar un hidruro de un alcohol para producir una cetona. En el mecanismo (con solo la parte de nicotinamida\(\mathrm{NADH}\) mostrada) el grupo “\(\mathrm{R}\)” unido al\(\mathrm{N}\) en el anillo es en realidad una molécula compleja que consiste en un resto adenina (una base que se encuentra en ácidos nucleicos y nucleótidos), dos unidades de azúcar (ribosa) y dos enlaces fosfato. Por ahora, centrémonos en las similitudes entre las reacciones de reducción discutidas anteriormente y las que tienen lugar en los sistemas biológicos.
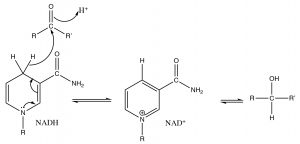
Reducción de un carbonilo\(\mathrm{NADH}\) mediante el suministro de carbono\(\mathrm{H}^{-}\) al carbonilo
La conversión del ácido pirúvico en ácido láctico durante la glucólisis es solo un ejemplo de ello. Al observar sistemas más simples, podemos entender (y modelar) los tipos de reacciones que ocurren en los organismos.
Los alcoholes también se pueden producir por reducción directa con\(\mathrm{H}_{2}\) (g) usando un catalizador de metal de transición, de una manera similar a la reducción de\(\mathrm{C=C}\), excepto que los hidrógenos se suman a través del\(\mathrm{C=O}\).
La elección del agente reductor depende de la presencia de otros grupos funcionales dentro de la molécula. Por ejemplo, si quisiéramos reducir un grupo carbonilo en una molécula que también tuviera un doble enlace carbono-carbono, no lo usaríamos\(\mathrm{H}_{2} / \mathrm{Pd}\) como reactivo/catalizador, ya que también reduciría el doble enlace como se muestra aquí (\(\rightarrow\)).
Preparación de alcoholes con reactivos de Grignard:
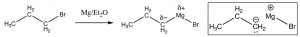
Así como podemos agregar ion hidruro por un ataque nucleofílico a un carbonilo, también podemos agregar un grupo alquilo, que formalmente contiene un carbanión (un carbono cargado negativamente). La forma más común de hacerlo es a través de un reactivo de Grignard [8], producido haciendo reaccionar un haluro de alquilo con magnesio metálico en atmósfera seca con un disolvente no prótico como el éter dietílico (\(\mathrm{Et}_{2}\mathrm{O}\)). El reactivo de Grignard resultante,\(\mathrm{RMgBr}\), ahora está polarizado con una gran carga negativa parcial sobre el carbono.
Para nuestros propósitos, podemos tratar al Grignard como si se tratara de un carbanión, que reaccionará con un grupo carbonilo de la misma manera que un ion hidruro. [9]
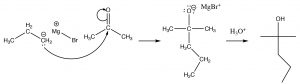
Reacción de un reactivo de Grignard con una cetona para dar un alcohol
Esta reacción es aplicable a una amplia gama de compuestos que contienen grupos carbonilo incluyendo aldehídos y cetonas, y (como veremos más adelante) a ésteres y cloruros de ácido, pero no ácidos carboxílicos (¿por qué crees que es eso?).


