7.14: Reacciones nucleofílicas de adición y eliminación de ácidos y derivados
- Page ID
- 76937
Al igual que con los aldehídos y cetonas, la reacción de ácidos y derivados con nucleófilos de oxígeno y nitrógeno es algo más compleja: en cada paso, existe el potencial de reversión. La formación y descomposición del intermedio tetraédrico nuevamente juega un papel central en el resultado de la reacción, y es posible utilizar el conocimiento de estructura y propiedades para predecir cómo procederá la reacción. Además, con un conocimiento de cómo las concentraciones de reactivos y productos afectan las posiciones de equilibrio, podemos controlar el resultado de las reacciones usando el Principio de Le Chatelier.
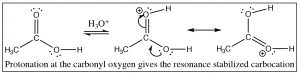
Primero, consideraremos la reacción de un ácido carboxílico con un alcohol que conduce a la formación de un éster. La reacción se realiza típicamente con un catalizador ácido y dada esa información, deberías poder escribir el mecanismo. El primer paso es la protonación; mientras que hay dos oxígenos potencialmente básicos, la protonación tiende a ocurrir preferentemente en el oxígeno carbonilo (no el\(\mathrm{OH}\)) porque el catión resultante puede estabilizarse por resonancia. Al igual que con los aldehídos y cetonas, la protonación activa el carbonilo y el siguiente paso es el ataque del nucleófilo, en este caso un alcohol. En el siguiente esquema de reacción, el etanol reacciona con ácido acético para dar acetato de etilo.
La parte crucial de este mecanismo es la serie de intermedios tetraédricos que se interconvierten protonando y desprotonando los tres oxígenos diferentes. Dado que todos estos grupos son similares (\(\mathrm{OH}\)o\(\mathrm{OR}\)) la probabilidad de que cada uno de estos grupos se vaya es más o menos la misma una vez que están protonados. Al igual que con los aldehídos y cetonas, el sistema se volverá más estable (con enlaces más fuertes) si el grupo carbonilo se reforma mediante la eliminación de uno de los grupos unidos al carbono. Nuevamente, podemos cambiar el equilibrio para esta reacción manipulando las condiciones de reacción. Por lo general, las esterificaciones se llevan a cabo utilizando el alcohol como disolvente (por lo que está en gran exceso), y el agua producida se elimina a medida que se forma.
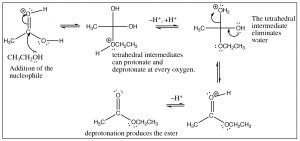
Como cabría esperar, esta reacción es completamente reversible, y la reacción inversa se lleva a cabo típicamente en solución acuosa con catálisis ácida o básica. De hecho, esta reacción es la base de la saponificación (fabricación de jabón); en la que los ésteres de ácidos grasos de cadena larga de glicerol (triglicéridos) se hidrolizan en una solución acuosa con un catalizador base.
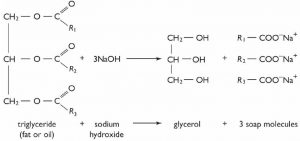
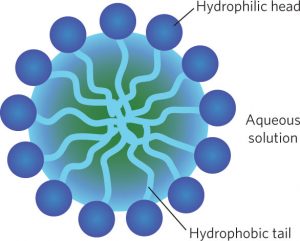
El triglicérido (grasa o aceite) es insoluble en agua, mientras que la sal sódica del ácido graso de cadena larga (jabón) es soluble. Las moléculas de jabón se agregan para formar micelas esféricas en las que los grupos de cabeza polar se encuentran en el exterior y las colas no polares están dentro [9].


