8.4: Espectroscopia UV-VIS y Sistemas Conjugados- Revisión
- Page ID
- 76776
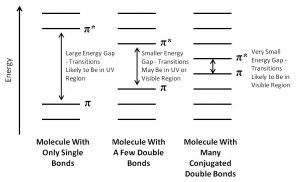
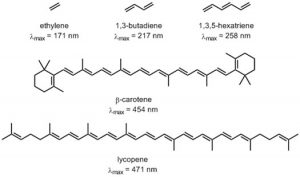
Como probablemente recuerdes, cuantos más orbitales atómicos se combinen para producir orbitales moleculares, menor será la brecha de energía entre los\(\mathrm{MO}\) s. Por ejemplo, un electrón en un enlace pi aislado absorbe energía en el lejano UV (\(\sim 170 \mathrm{~nm}\)), una energía bastante alta. A medida que aumentamos el número de dobles enlaces conjugados, la brecha de energía entre los orbitales (de hecho la brecha entre HOMO y LUMO) se hace cada vez más pequeña, de manera que los fotones de menor energía pueden provocar esta transición. Finalmente, la longitud de onda de la luz necesaria para promover un electrón desde el más alto ocupado hasta el más bajo desocupado\(\mathrm{MO}\) (\(\mathrm{HOMO} \rightarrow \mathrm{LUMO}\)) se mueve hacia la región visible, y la sustancia se vuelve coloreada. Tenga en cuenta que su color no representa la luz que se absorbe, sino la luz que se transmite o refleja. Estas regiones conjugadas de moléculas se denominan cromóforos. [3] Cuanto más larga sea la sección conjugada de la molécula, mayor será la longitud de onda que se absorbe. Los compuestos responsables de frutas y vegetales altamente coloreados, como el licopeno y el B-caroteno, así como su capacidad para ver la luz visible (retinales) contienen grandes regiones cromóforos.
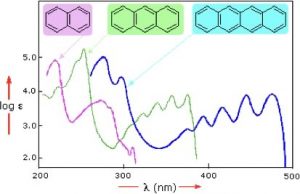
Aquí se muestran muestras de espectros de absorción UV-VIS (\(\rightarrow\)). Obsérvese que, en contraste con la mayoría de las otras técnicas espectroscópicas (que suelen producir líneas nítidas), los picos en estos espectros son más amplios; cuanto más larga es la sección conjugada del cromóforo, más larga es la longitud de onda (y menor energía) que absorbe. Esto significa que cada uno de estos compuestos tiene un color diferente. Además, el hecho de que los picos en estos espectros no sean agudos significa que la espectroscopia UV-VIS normalmente no se usa para la identificación de compuestos. Sin embargo, la cantidad de luz absorbida es proporcional a la concentración de la sustancia, por lo que la espectroscopia UV-VIS puede ser utilizada para determinar la concentración de muestras. El espectro visible va de aproximadamente\(300 \mathrm{~nm}\) a\(750 \mathrm{~nm}\).
Reacciones de Sistemas Conjugados: Control Cinético y Termodinámico de Reacciones:
Ahora consideremos la reacción del 1,3-butadieno con un reactivo como\(\mathrm{HCl}\). Así como vimos con alquenos aislados, el primer paso en la reacción es la adición del electrófilo\(\mathrm{H}^{+}\) para producir el carbocatión más estable. En esta reacción, el protón se suma a C-1; el carbocatión resultante se estabiliza por resonancia con carga positiva tanto en C-2 como en C-4. La pregunta, entonces, es: ¿dónde agrega el nucleófilo?
![]()
De hecho, la posición de equilibrio depende de las condiciones bajo las cuales se produce la reacción. Primero, consideremos los dos posibles sitios de ataque. El ataque a C-2 significaría que el reactivo se ha agregado a través del enlace pi C-1/C-2, esto se llama adición 1,2. El ataque a C-4 se llama 1,4-adición y los dos productos son claramente diferentes.
![]()
La carga positiva parcial en C-2 se localiza sobre un carbono secundario, mientras que en el C-4 se encuentra en un carbono primario. Esto significa que el carbocatión intermedio tiene más carga positiva parcial en C-2 que en C-4 y el estado de transición para que la reacción dé el producto de adición 1,2-tendrá una energía de activación menor que el estado de transición para el producto 1,4 porque está más estabilizado (por inducción e hiper- conjugación). Por lo tanto, el ataque del nucleófilo (cloruro) ocurriría más rápido en C-2; es decir, la adición 1,2 es el producto cinéticamente favorecido.
Sin embargo, si consideramos el producto de adición 1,4, el producto alqueno en sí está más sustituido (hay dos grupos alquilo en el doble enlace) y, por lo tanto, es más estable que el producto de la adición 1,2. A pesar de que el producto de adición 1,4-se forma más lentamente a través de un estado de transición menos estabilizado, el producto en sí es más estable; es el producto termodinámicamente favorecido.
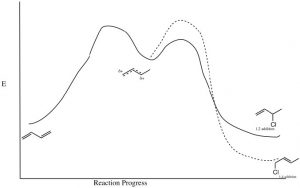
De hecho, controlando las condiciones de reacción, es posible producir el producto cinético o termodinámico. Si la reacción se lleva a cabo a una temperatura relativamente baja, no habrá suficiente energía para superar la barrera de energía de activación asociada con la reacción del producto de adición 1,4 y se producirá el producto cinético (1,2). Sin embargo, a temperaturas más altas, hay suficiente energía; la barrera de energía de activación 1,4 se alcanzará con mayor frecuencia, de manera que aunque se forme el producto cinético, el hecho de que la reacción sea reversible conducirá, con el tiempo, a que el producto más estable se acumule en equilibrio. Es importante señalar que el producto más estable no siempre se forma, depende de las condiciones de reacción.
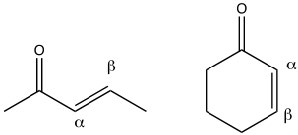
Compuestos de carbonilo conjugados:
Los compuestos carbonílicos también se pueden conjugar con dobles enlaces carbono-carbono. Estos compuestos a menudo se denominan carbonilos insaturados α, β (el carbono al lado del carbono carbonilo se denomina carbono alfa). Al dibujar formas de resonancia para este sistema, vemos que hay una carga positiva parcial en el carbono carbonilo y en el\(\beta\) carbono. Esto significa que los compuestos carbonílicos\(\alpha , \beta\) insaturados son susceptibles al ataque nucleofílico tanto en el\(\mathrm{C=O}\) carbono como en el\(\beta\) carbono. Lo cual es análogo a las adiciones 1,2 y 1,4-a los dienos conjugados.
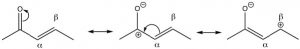
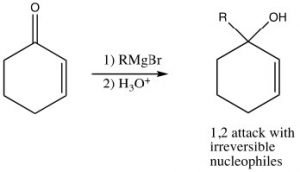
Al igual que en el caso del dieno 1,3-conjugado, el ataque al carbono carbonilo es el producto cinéticamente preferido ya que allí hay más carga positiva y la reacción es más rápida. Reactivos que atacan a carbonilos irreversiblemente, como grignards, alquil-litios, o agentes reductores como\(\mathrm{LiAlH}_{4}\), por lo tanto, tienden a producir el producto de ataque al carbonilo. Este es el producto de adición 1,2.
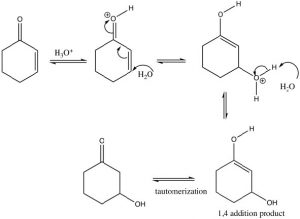
Si utilizamos un nucleófilo reversible (\(\mathrm{ROH}\),\(\mathrm{H}_{2}\mathrm{O}\),\(\mathrm{RNH}_{2}\)), entonces predominará el producto termodinámicamente más estable, es decir, el producto de la adición 1,4. Sin embargo, este producto sufre un tautomerismo [4] que regenera el carbonilo (que es la fuente de la estabilidad, los\(\mathrm{C=O}\) enlaces de recuerdo son muy fuertes).
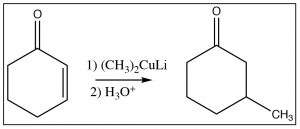
Otro reactivo que puede producir un producto resultante del ataque al carbono beta es un reactivo que aún no hemos visto, un organocuprato, también conocido como el reactivo Gilman [5], que consiste en un complejo de grupos alquilo, cobre y litio y tiene la fórmula genérica \(\mathrm{R}_{2}\mathrm{CuLi}\). Aquí se muestra la reacción general. El organocuprato tiene los dos grupos alquilo unidos a la especie de cobre (formalmente\(\mathrm{Cu}^{2+}\)), pero el enlace carbono-cobre es más covalente que iónico (la carga en el carbono es menor que en el equivalente Grignard o reactivo de alquil litio) y esto hace que el ataque al carbono beta sea más probable. [6]
![]()
Los reactivos Gilman también son muy útiles porque pueden lograr un ataque nucleofílico sobre haluros de alquilo, lo que no ocurre con los reactivos de Grignard o alquil-litio.

