1.3: Estructuras de resonancia
- Page ID
- 76422
En el caso de que se pueda dibujar más de una estructura razonable (plausible) de Lewis para una especie, estas estructuras se denominan estructuras de resonancia o contribuyentes de resonancia. Las estructuras de resonancia pueden ser equivalentes o no equivalentes.
Estructuras de resonancia equivalentes
Consideremos el ejemplo del anión carbonato, CO 3 2-:
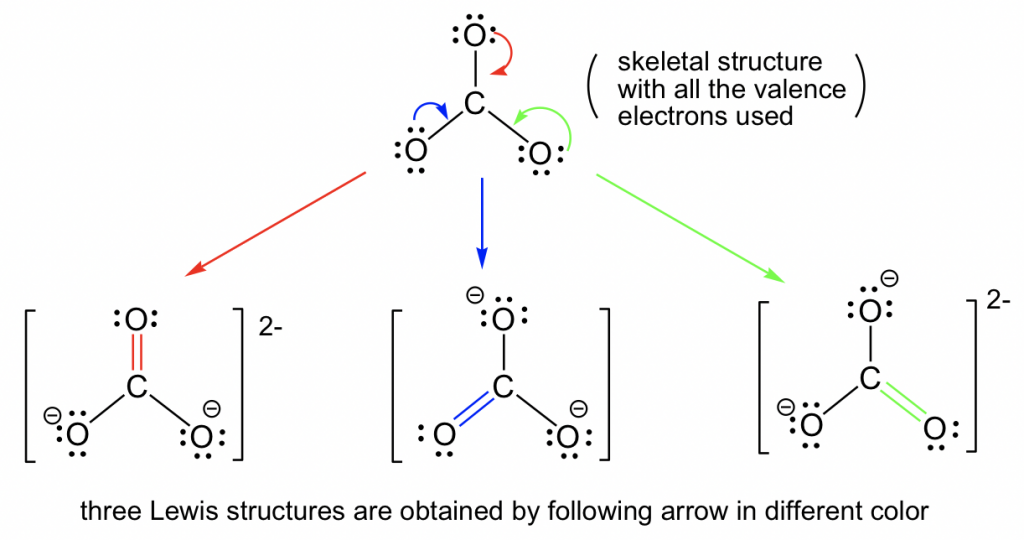
Siguiendo el Paso 6 en el procedimiento de dibujo de la estructura de Lewis, se puede construir el doble enlace entre la C central y cualquiera de las O terminales para generar tres estructuras, y todas se ven “iguales”. Sin embargo, no son realmente idénticos (o iguales), solo son equivalentes. Cada estructura se llama estructura de resonancia, y se pueden conectar por la flecha de resonancia de dos puntas. Hay un total de tres estructuras de resonancia equivalentes para CO 3 2-, y la estructura real del CO 3 2- es el híbrido de los tres contribuyentes de resonancia.
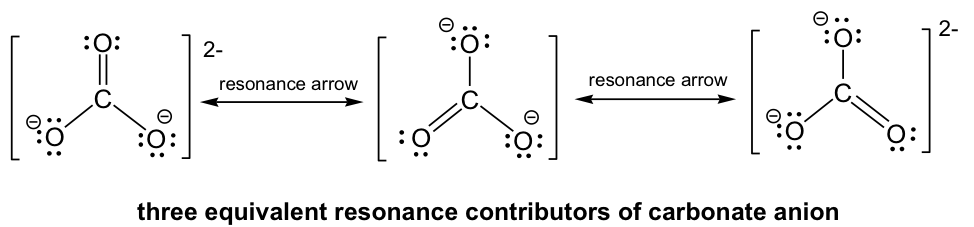
Dado que las estructuras de resonancia son equivalentes, todas están en el mismo nivel de energía y tienen la misma estabilidad, por lo que hacen las mismas contribuciones a la estructura real del CO 3 2-. Esto está respaldado por la evidencia experimental de que todos los enlaces carbono-oxígeno en CO 3 2- tienen la misma longitud de enlace, que es más larga que un doble enlace regular pero más corta que un enlace simple. Como resultado de las estructuras de resonancia, las dos cargas negativas en CO 3 2- no se localizan en ningún átomo de oxígeno, sino que se distribuyen uniformemente entre los tres átomos de oxígeno, y se llama deslocalización de carga. Debido a la deslocalización de carga, cada átomo de oxígeno tiene dos tercios de una carga negativa completa. La deslocalización de carga ayuda a estabilizar toda la especie. La estabilidad que una especie obtiene al tener deslocalización de carga a través de contribuyentes de resonancia se llama efecto de estabilización de resonancia. Cuanto mayor sea el número de contribuyentes de resonancia, mayor será el efecto de estabilización de resonancia y más estable es la especie.
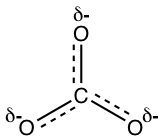
La estructura real del anión carbonato es una combinación de las tres estructuras de resonancia equivalentes, que se pueden llamar híbridas. ¿Qué aspecto tiene la estructura real y podemos dibujar una estructura en papel para mostrar la estructura real? La estructura real no se puede mostrar con una estructura de Lewis convencional, debido a que las estructuras regulares de Lewis no incluyen cargas parciales, y hay dos tercios de una carga negativa completa en cada átomo de oxígeno en CO 3 2-. Un intento de mostrar la estructura híbrida puede ser mediante el uso de líneas discontinuas para mostrar que el enlace entre el carbono y el oxígeno está en algún lugar entre un enlace simple y doble, y cada átomo de oxígeno tiene cargas parciales.
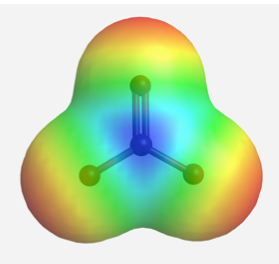
Las cargas deslocalizadas también pueden ser representadas por el mapa de potencial electrostático calculado de la densidad electrónica en el anión CO 3 2-. En un mapa de potencial electrostático, las regiones con diferentes cargas se muestran en diferentes colores. Más específicamente, los colores que tienden hacia el rojo significan mayores cargas negativas, mientras que los colores que tienden hacia el azul significan una carga más positiva (el sistema de color generado por diferentes softwares podría no ser el mismo, pero seguirá la misma tendencia). En el mapa de potencial electrostático del anión carbonato a continuación, el mismo tono de rojo de los tres átomos de oxígeno indica la distribución de carga igual en los tres átomos de oxígeno.
Ejercicios 1.5
Dibujar todas las estructuras de resonancia equivalentes para las siguientes especies. Incluir cualquier cargo formal distinto de cero en las estructuras.
- Molécula O 3
- anión nitrato NO 3 —
- anión clorato ClO 3 —.
Respuestas a las preguntas de práctica Capítulo 1
Estructuras de resonancia no equivalentes
Las estructuras de resonancia también pueden ser no equivalentes. Para el ejemplo de OCN, existen tres estructuras de resonancia no equivalentes, dependiendo de cómo se formen los enlaces múltiples en el Paso 6 del procedimiento de dibujo de estructuras de Lewis.
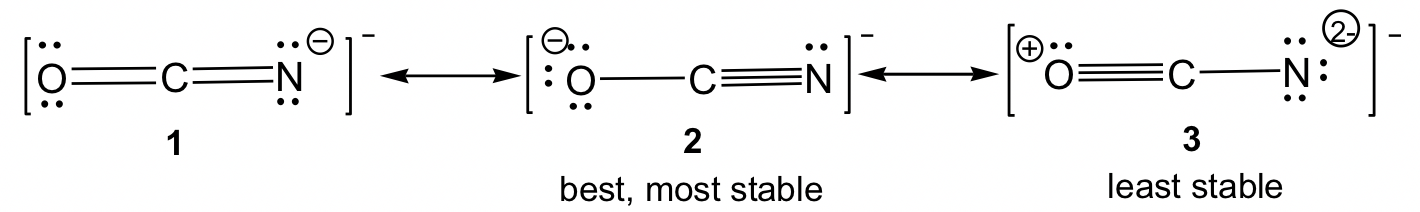
Para las estructuras de resonancia no equivalentes, las distribuciones de unión y carga son diferentes, por lo que están en diferentes niveles de energía. Algunas son estructuras de resonancia más estables (mejores) que otras. Las pautas para comparar la estabilidad relativa entre estructuras de resonancia no equivalentes son (cuanto menor es la energía, más estable es la estructura y viceversa):
- La estructura con octetos completos suele ser más estable, salvo en los casos de la sección 1.2.4 “Excepciones a la Regla del Octeto”.
- La estructura que involucra los cargos formales más pequeños es más estable.
- Las cargas negativas deben ubicarse preferentemente en átomos con mayor electronegatividad, y las cargas positivas deben ubicarse preferentemente en átomos con menos electronegatividad
- La separación de carga disminuye la estabilidad (aumenta la energía).
Al aplicar las reglas anteriores, podemos predecir que para OCN —, la estructura 3 es la menos estable ya que tiene los cargos formales más altos. Para ambas estructuras 1 y 2, el cargo formal es “-1”. Es más preferible que las cargas formales negativas estén sobre el oxígeno, el átomo más electronegativo; por lo tanto, la estructura 2 es la más estable.
Ejercicios 1.6
Dibujar todas las estructuras de resonancia para anión azida, N 3 —, e indicar el o ne más estable.


