1.4: Estructuras de resonancia en Química Orgánica
- Page ID
- 76400
El efecto de estabilización de resonancia (también conocido como efecto de resonancia), como se menciona brevemente en la Sección 1.3, es uno de los conceptos fundamentales de la Química Orgánica y tiene amplias aplicaciones. La discusión del efecto de resonancia se basa en gran medida en la comprensión de las estructuras de resonancia. Aquí nos centraremos en cómo dibujar estructuras de resonancia (o contribuyentes de resonancia) para especies de química orgánica, y cómo comparar las estabilidades relativas entre las estructuras.
Según el efecto de resonancia, cuanto mayor sea el número de contribuyentes de resonancia, mayor será el efecto de estabilización de resonancia y más estable es la especie. Por lo tanto, para predecir si el efecto de resonancia se aplica o no, generalmente necesitamos construir “nuevas” estructuras de resonancia (contribuyentes) basadas en la “original” que está disponible. Hay algunas reglas muy importantes que debemos seguir para tales fines.
Directrices para dibujar estructuras de resonancia:
- Todas las estructuras de resonancia deben ser estructuras de Lewis válidas. (¡Ten en cuenta que todas las reglas aplicadas a las estructuras de Lewis todavía se aplican aquí!)
- Todas las estructuras de resonancia deben tener la misma conectividad atómica, y solo diferir en la disposición de los electrones. (Los átomos NUNCA se mueven, solo los electrones se mueven.)
- Todas las estructuras de resonancia tienen el mismo número de electrones y carga neta. (Las cargas formales sobre el átomo individual podrían ser diferentes, pero la carga neta, es decir la suma de todas las cargas, debe ser la misma.)
- Para mover electrones, solo electrones π y electrones de par solitario (¡NUNCA mueva los enlaces σ!) se puede mover desde el área de mayor densidad de electrones al área de menor densidad electrónica siguiendo una de las tres transformaciones:
- el enlace π forma otro enlace π;
- el enlace π forma los electrones de par solitario;
- electrones de par solitario forman un enlace π.
- Use flechas curvas para indicar el movimiento de electrones en la estructura de resonancia “original”. La “nueva” estructura de resonancia debe ser un “producto” obtenido automáticamente siguiendo las flechas.
- Calcular el cargo formal en la “nueva” estructura y etiquetar cualquier cargo formal distinto de cero.
Ejemplos: Dibujar otra estructura de resonancia basada en la dada.
1.
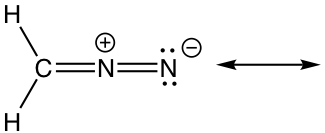
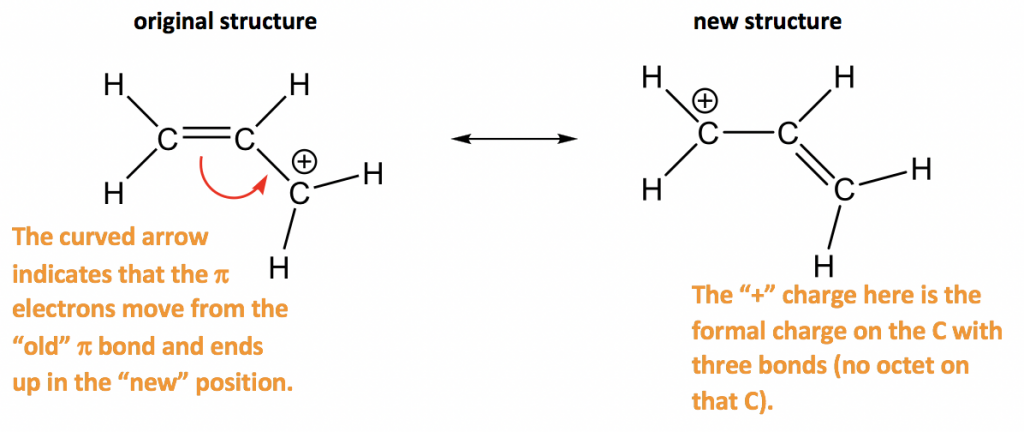
Enfoque: Solo hay un enlace π en este ejemplo, y no hay pares solitarios, por lo que solo se pueden mover los electrones π. Hay un carbocatión al lado del enlace π, que es el punto de baja densidad de electrones. Por lo tanto, es razonable mover los electrones π a la posición junto al carbocatión para formar otro enlace π, y eso le da la “nueva” estructura. Las dos estructuras de resonancia aquí son equivalentes.
Solución
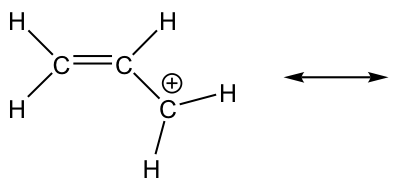
2.
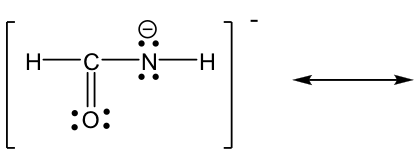
Enfoque: Más electrones disponibles para el movimiento en este ejemplo: varios pares solitarios y un enlace π. La pauta de “mover electrones del área de mayor densidad de electrones al área de menor densidad electrónica” proporciona una pista útil sobre por dónde comenzar. El átomo de nitrógeno tiene una carga formal “-”, lo que significa que tiene una densidad electrónica relativamente alta, mayor que otras manchas neutras. Por lo tanto, es razonable alejar el par solitario en nitrógeno para formar un enlace π (tenga en cuenta que el par solitario solo puede formar un enlace π, no otro par solitario). Sin embargo, cuando se forma el nuevo enlace π alrededor del átomo de carbono, hay 5 enlaces (10 electrones) en ese carbono, lo que no está permitido. Entonces, otro par de electrones tiene que alejarse, y el único par de electrones disponible para moverse son los electrones π en el enlace C=O. Se puede mover al átomo de oxígeno y convertirse en otro par solitario en el átomo de oxígeno.
Solución:
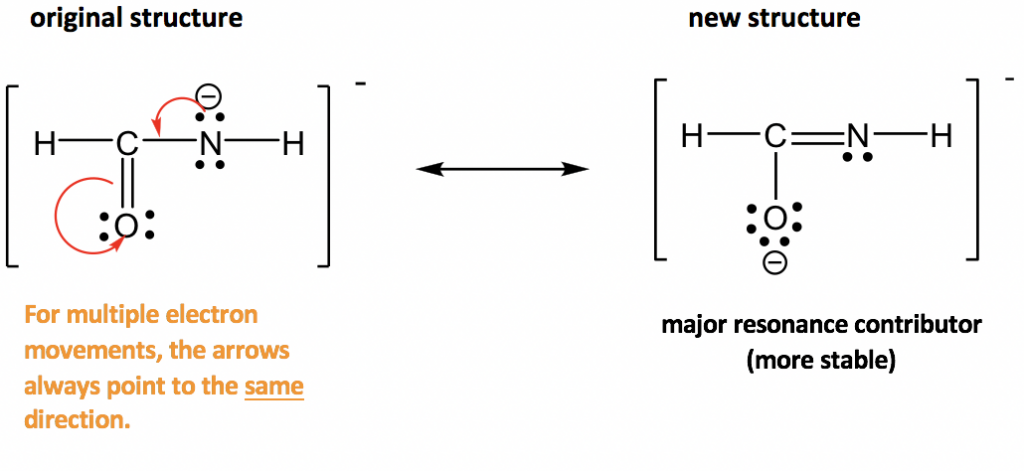
Las dos estructuras de resonancia en este ejemplo no son equivalentes, por lo que una es más estable que la otra. Al aplicar la directriz formal de carga, la carga formal “- “es más preferible sobre el oxígeno, que es más electronegativa que el nitrógeno, por lo que la segunda estructura es la más estable con menor energía, y hace más contribución a la estructura real en esta especie. La estructura más estable también se puede llamar como el principal contribuyente de resonancia.
Comparando la estabilidad relativa de diferentes contribuyentes de resonancia:
- Las estructuras con un máximo de octetos son las más importantes.
- La separación de carga generalmente disminuye la estabilidad (aumenta la energía del contribuyente).
-
Las cargas negativas deben ubicarse preferentemente en átomos con mayor electronegatividad, y las cargas positivas deben ubicarse preferentemente en átomos con menos electronegatividad.
Errores comunes para dibujar estructuras de resonancia:
- se mueve el enlace σ
- Atom se mueve
- Más de ocho electrones ubicados alrededor de C, N u O
- Las flechas no se muestran de la manera adecuada
- Los pares de electrones se mueven demasiado lejos, solo deben moverse a la siguiente posición/átomo.
Ejercicios 1.7 Dibujar nueva estructura de resonancia y comparar la estabilidad relativa, mostrar flechas en la estructura original.
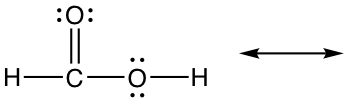
2.