1.5: Teoría de Repulsión de Par de Electrones de Valencia-Shell (VSEPR)
- Page ID
- 76413
La teoría de la repulsión de pares de electrones de Valencia-Shell (VSEPR) nos ayuda a comprender y predecir la geometría (forma) de moléculas o iones. La teoría es:
- Los pares de electrones se repelen entre sí ya sean en enlaces químicos o pares solitarios.
- Los pares de electrones de valencia están orientados para estar lo más separados posible para minimizar las repulsiones.
Con base en esta teoría, dependiendo del número de pares de electrones (tanto pares de enlace como pares solitarios) alrededor del átomo central, se adopta una cierta forma para minimizar la repulsión entre pares electorales, como se resume en la siguiente tabla:
|
Número total de grupos de electrones (pares de electrones) alrededor del átomo central |
Geometría (Forma) de grupos de electrones (pares de electrones) |
|
2 |
lineal |
| 3 | plano trigonal |
| 4 | tetraédrico |
| 5 | bipiramidal trigonal |
| 6 | octaédrico |
Tabla 1.1 Formas básicas de VSEPR
Notas:
- Para el propósito de VSEPR, los términos “forma” y “geometría” son intercambiables; “par de electrones” y “grupo de electrones” también son intercambiables.
- Los enlaces múltiples (doble o triple enlace) se consideran como un grupo de electrones para el propósito de VSEPR.
Para las especies que no tienen electrones de par solitario (LP), la geometría (forma) de la especie es exactamente la misma que la geometría de los grupos de electrones.
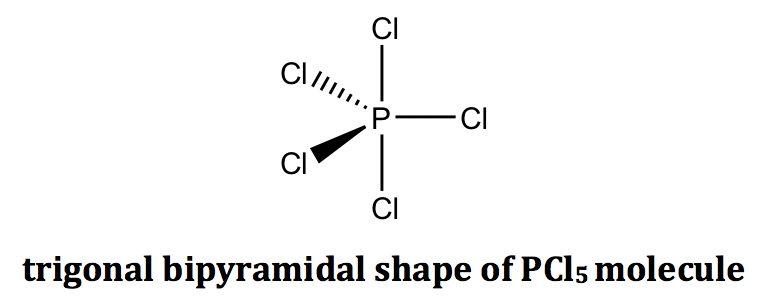
Para el ejemplo e de la molécula pCl 5, hay cinco grupos de electrones en el fósforo central, y todos son pares de enlace (BP). La forma de los grupos de electrones es bipiramidal trigonal, y la forma de la molécula pCl 5 es bipiramidal trigonal también. La forma bipiramidal trigonal se puede dibujar sobre papel usando cuñas sólidas y discontinuas: los tres enlaces se encuentran dentro del plano de papel se muestran como líneas ordinarias, la cuña sólida representa un enlace que apunta hacia fuera del plano de papel, y la cuña discontinua representa un enlace que apunta detrás del plano de papel.
Sin embargo, para la especie que tiene electrones de par solitario en el átomo central, la forma de la especie será diferente a la forma de los grupos de electrones. La razón es que a pesar de que las parejas solitarios ocupan el espacio, no hay átomos terminales conectados con la pareja solitaria, por lo que la pareja solitaria se vuelve “invisible” por la forma de la especie.
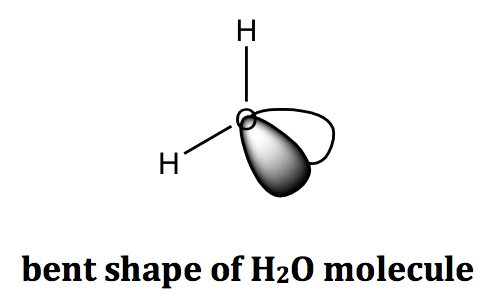
Para el ejemplo de la molécula de agua (H 2 O), el átomo de oxígeno central tiene dos BP y dos LP, y la forma de todos los grupos de electrones es tetraédrica. La forma de una molécula de agua está doblada porque solo los átomos se cuentan hacia la forma molecular, no los electrones del par solitario.
Las formas de VSEPR pueden ser bastante diversas, considerando los diferentes números de pares de electrones totales junto con los diferentes números de pares solitarios involucrados. Las formas más comunes se resumen en la siguiente tabla (Cuadro 1.2). Para describir una determinada forma, el nombre específico debe usarse correctamente, y la información del ángulo de unión también es importante.
| Número total de e-grupos | Geometría (forma) de todos los grupos de electrones | # de pares de unión (BP) y pares solitarios (LP) | Geometría (forma) de la especie | Ángulos (°) |
| 2 | lineal | 2BP | lineal | 180 |
| 3 | plano trigonal | 3BP | plano trigonal | 120 |
| 2BP, 1LP | doblada | <120 | ||
| 4 | tetraédrico | 4BP | tetraédrico | 109.5 |
| 3BP, 1LP | piramidal trigonal | <109.5 | ||
| 2BP, 2LP | doblada | <109.5 | ||
| 5 | bipiramidal trigonal | 5BP | bipiramidal trigonal | 120, 90, 180 |
| 4BP, 1LP | ver-sierra | <120, 90, 180 | ||
| 3BP, 2LP | Forma de T | 90, 180 | ||
| 2BP, 3LP | lineal | 180 | ||
| 6 | octaédrico | 6BP | octaédrico | 90, 180 |
| 5BP, 1LP | cuadrado piramidal | 90, 180 | ||
| 4BP, 2LP | plano cuadrado | 90, 180 |
Tabla 1.2 Resumen de formas específicas de VSEPR
El sitio web https://phet.colorado.edu/sims/html/molecule-shapes/latest/molecule-shapes_en.html proporciona buenos recursos para visualizar y practicar temas de VSEPR.
Veremos más aplicaciones de VSEPR en compuestos orgánicos en la siguiente sección.


