3.3: pKa de ácidos orgánicos y aplicación de pKa para predecir el resultado de la reacción ácido-base
- Page ID
- 76342
Como mencionamos antes, todos los compuestos orgánicos podrían ser ácidos, porque todos tienen átomos de hidrógeno que potencialmente podrían ser donados. La mayoría de los ácidos orgánicos son ácidos débiles con un K a pequeño, por ejemplo, el ácido acético CH 3 COOH tiene una K a de 1.8×10 -5. Muchos otros ácidos orgánicos son incluso más débiles que el ácido acético, y es esta débil acidez la que hace difícil darse cuenta de que algunos compuestos orgánicos son en realidad ácidos.
Sin embargo, esta débil acidez es muy importante en Química Orgánica. Dado que no es muy conveniente decir o recordar valores de K a como 1.8×10 -5, p K a se usa con mayor frecuencia en Química Orgánica para referirse a la acidez relativa de diferentes ácidos. La definición de p K a es:
p K a = -log K a
Cuanto menor sea el valor de p K a, mayor será la K a, y más fuerte es la acidez.
El p K a de la mayoría de los ácidos orgánicos oscila entre 5~60. Si bien es imposible conocer la p K a de cada compuesto orgánico, es muy útil entender la p K a (y la acidez) en función de los grupos funcionales involucrados, ya que los mismos grupos funcionales suelen tener p K a s similares. rangos aproximados de valores de p K a para siete grupos funcionales principales se enumeran en la Tabla 3.1, que sirve como un punto de partida muy valioso para que podamos predecir y entender la acidez de cualquier molécula orgánica. El ácido orgánico más fuerte que se enumera aquí es el ácido carboxílico, con un p K a de aproximadamente 5; los ácidos orgánicos más débiles son los alcanos con valores de p K a superiores a 50. Dado que en la tabla se listan rangos aproximados de valores de p K a, el valor exacto de p K a de un grupo varía para diferentes compuestos debido a las diferencias estructurales. Afortunadamente sin embargo, generalmente no es necesario conocer los valores exactos de p K a para la mayoría de los casos en química orgánica, y el rango aproximado es lo suficientemente bueno.
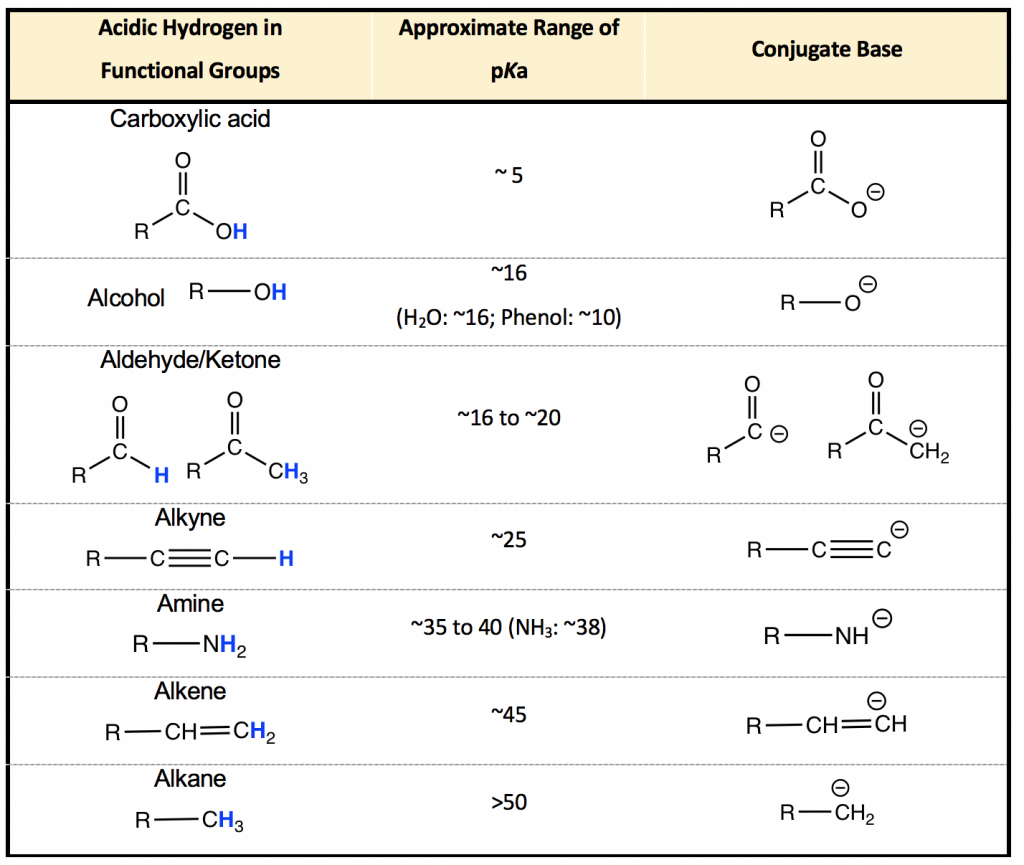
- La acidez es la capacidad de un compuesto para donar H +, por lo que cuando hablamos de la acidez (K a y p K a) de un compuesto orgánico, debe tratarse de un átomo de H específico (resaltado azul en la tabla). Para diferentes átomos de H en el mismo compuesto, la acidez y p K a son diferentes. En cuanto al ejemplo del metanol:

- Es muy útil memorizar los rangos aproximados de p K a enumerados en la Tabla 3.1.
- La acidez de los grupos funcionales en la tabla disminuye de arriba a abajo, y la basicidad de las bases conjugadas en la última columna aumenta de arriba a abajo, debido a que cuanto más fuerte es el ácido, más débil es la base conjugada.
Predecir el resultado de la reacción ácido-base orgánica — Usar p K a como criterio
Con el conocimiento de acidez y p K a, ahora estamos listos para ver cómo aplicar esta información a la comprensión de las reacciones orgánicas desde una perspectiva ácido-base.
La siguiente reacción es un ejemplo en la Sección 3.2. Si echas un vistazo más de cerca a los reactivos y productos, encontrarás que el lado del “producto” también contiene un ácido (amoníaco NH 3), y una base (metóxido CH 3 O —). Ahora la pregunta es, ¿cómo podemos estar tan seguros de que la reacción procede al lado del “producto” tal como está escrito? La pregunta también puede hacerse de otra manera: si se establece el equilibrio para la mezcla de reacción, ¿de qué lado favorecerá predominantemente la posición del equilibrio? ¿Izquierda o derecha?

Para responder a esa pregunta, aprenderemos sobre una regla general para la reacción ácido-base: las reacciones ácido-base siempre favorecen la formación del ácido más débil y de la base más débil. Esto se debe a que el equilibrio siempre favorece la formación de productos más estables, y los ácidos y bases más débiles son más estables que los más fuertes.
![HA (ácido más fuerte) + B (base más fuerte) [pKa más pequeño] = A- (base más débil) + HB+ (ácido más débil) [pKa más grande]](https://chem.libretexts.org/@api/deki/files/397335/equilibrium-reaction-2.png)
Con los valores de p K a disponibles a la mano, la acidez relativa de los reactivos frente a los productos se puede comparar comparando sus valores de p K a, y la reacción procederá al lado del ácido con a mayor pK a (mayor p K a significa menor K a, por lo tanto, ácido más débil).
Entonces para esta reacción, el cheque p K a indica que el amoníaco NH 3 es un ácido más débil que el metanol CH 3 OH, por lo que la reacción sí procede al lado derecho con CH 3 O — y NH 3 como los principales productos.

Notas: Solo comparar entre ácidos es lo suficientemente bueno para este propósito, ya que si CH 3 OH es más fuerte que NH 3, entonces la base conjugada CH 3 O —debe ser más débil que la otra base NH 2 —.
Ejemplos
Mostrar los productos de las siguientes reacciones y predecir el lado predominante del equilibrio.
Reacción 1
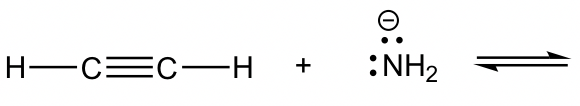
Reacción 2
![]()
Soluciones:
Reacción 1
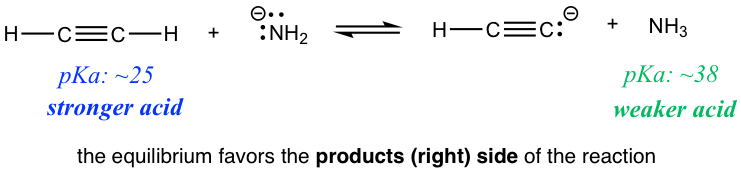
Reacción2
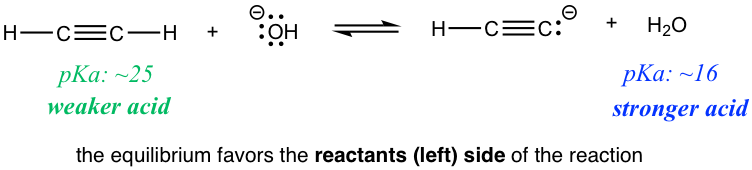
¿Hay alguna aplicación práctica para tal predicción? ¡Sí! Comparemos las dos reacciones en los ejercicios anteriores. La reacción 1 indica que si se mezclan entre sí etino (HC≡CH) y amida (NH 2 —), la reacción procede al lado de los productos, lo que significa que HC≡ CH podría desprotonarse por la amida NH 2 —. Sin embargo, si HC≡ CH e hidróxido OH — se mezclan entre sí como se muestra en la reacción 2, no se produce ninguna reacción, o podemos decir que HC≡CH no puede ser desprotonado por OH — porque OH — ¡no es lo suficientemente fuerte! Entonces, si estás trabajando en el laboratorio y tienes la opción de elegir entre NH 2 —u OH — para desprotonar HC≡ CH, ahora sabes cuál elegir.
La idea de que OH —no es una base lo suficientemente fuerte puede molestarte mucho, ya que entra en conflicto con el “conocimiento común” que aprendimos en Química General, donde OH — es una base fuerte. En términos generales, OH — es una base bastante fuerte; sin embargo, apenas no es lo suficientemente fuerte como para desprotonar HC ≡ CH, que es un ácido muy débil, con una p K a de aproximadamente ~25. Dado que HC ≡ CH es mucho más débil que los “ácidos débiles” que aprendimos en Química General, se requiere una base mucho más fuerte, como NH 2 —, para desprotonarla.

