7.4: Mecanismo de Reacción SN1, Diagrama de Energía y Estereoquímica
- Page ID
- 76451
Mecanismo de reacción S N 1
La reacción entre el bromuro de terc- butilo y el agua procede a través del mecanismo SN1. A diferencia de S N 2 que es una reacción de una sola etapa, la reacción de S N 1 implica múltiples etapas. Reacción: (CH 3) 3 CbR + H 2 O → (CH 3) 3 COH + HBr
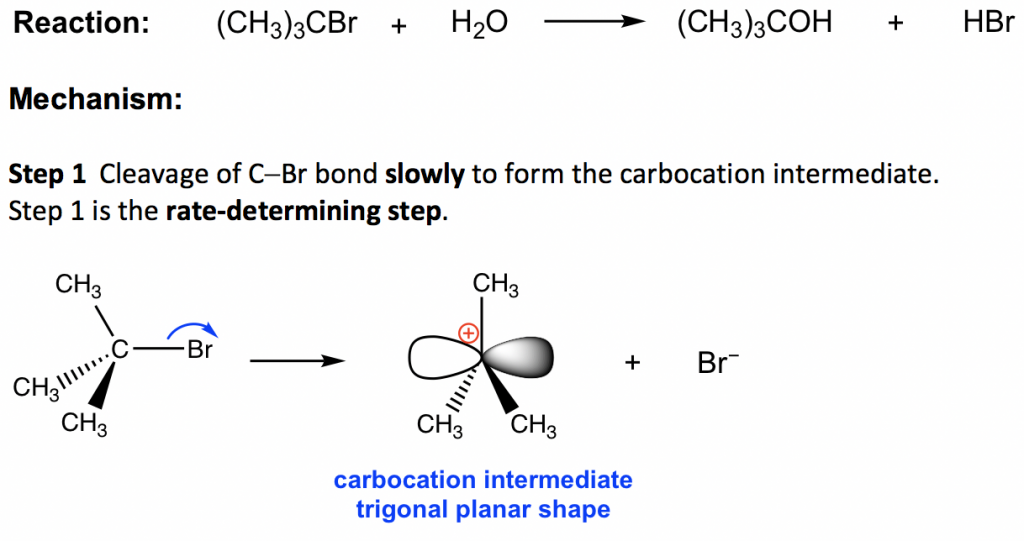
En la etapa 1, el enlace C—Br se rompe y Br sale con el par de electrones de enlace para producir un carbocatión terciario y anión bromuro Br —. Este paso solo implica un proceso de ruptura de unión altamente endotérmico, y este es el paso más lento en todo el mecanismo. En el mecanismo de múltiples etapas, la velocidad de reacción global está determinada por la etapa más lenta, por lo tanto, dicha etapa se denomina etapa de determinación de velocidad. En la reacción SN1, la etapa 1 es la etapa más lenta y, por lo tanto, la etapa de determinación de la velocidad. La etapa de determinación de la velocidad solo involucra al sustrato de haluro de alquilo, es por eso que la ley de velocidad general está en primer orden, porque el nucleófilo no participa en la etapa de determinación de la velocidad.
El producto de la etapa 1, carbocatión, será el reactivo de la siguiente etapa y se denomina el intermedio para la reacción de S N 1. Intermedio es la especie inestable, altamente reactiva con una vida útil muy corta. El intermedio de carbocatión está en forma plana trigonal, con el orbital 2p vacío particular al plano. El carbono central es sp 2 hibridado y tiene el octeto incompleto, por lo que el carbocatión es el intermedio altamente reactivo, que también es el electrófilo.
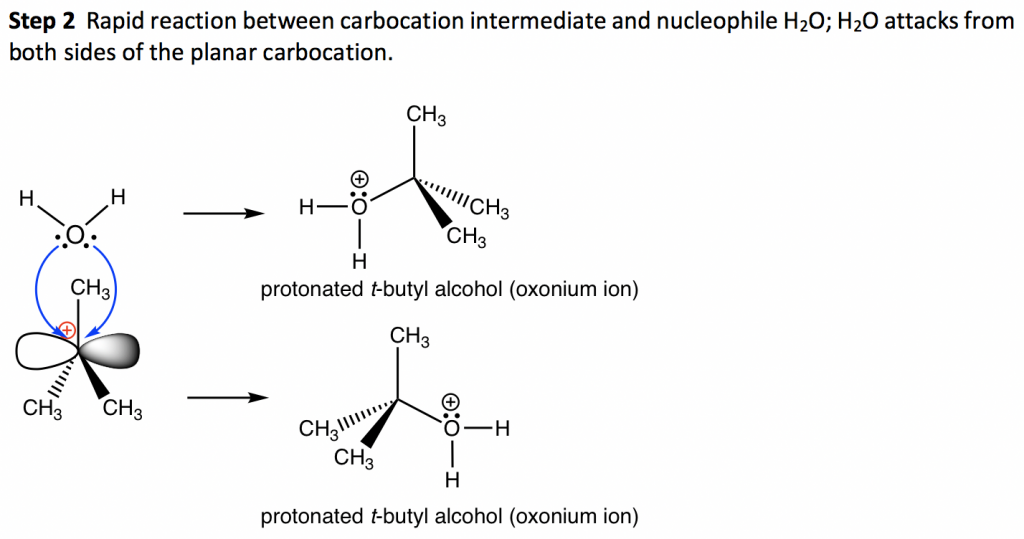
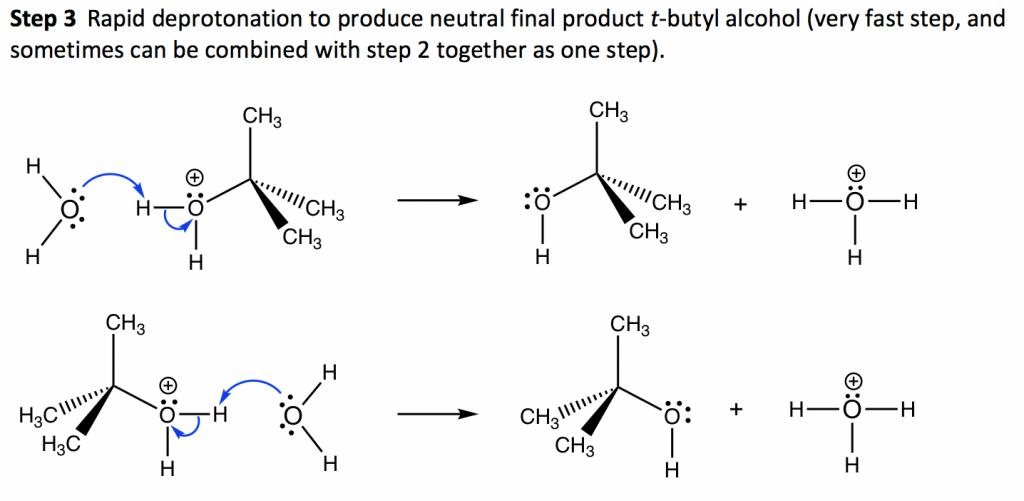
El paso 2 es el paso de ataque nucleofílico, que el nucleófilo H 2 O usa su par solitario para reaccionar con el intermedio carbocatión, y produce el alcohol t-butílico protonado (ion oxonio). Debido a la forma plana del carbocatión intermedio, existe la misma posibilidad de que el nucleófilo ataque desde cualquier lado del plano, por lo que se generan posibles productos con las mismas cantidades. Para esta reacción, atacar desde cualquier lado da el mismo producto (ambos aún se muestran con el propósito de ilustrar el concepto); sin embargo, da diferentes estereoisómeros si el carbono electrófilo es el centro de quiralidad. En la etapa 3, se produce una molécula de agua que actúa como base de Bronsted para aceptar el protón del ion oxonio, y el producto neutro final t-butil alcohol. Esta etapa de desprotonación es muy rápida y, a veces, se puede combinar con la etapa 2 conjuntamente como una etapa (es decir, la etapa 3 puede no considerarse como una etapa individual).Diagrama de energía del mecanismo S N 1
Debido a que S N 1 es una reacción de múltiples etapas, por lo que el diagrama tiene múltiples curvas, con cada paso puede ser representado por una curva. De los tres pasos, la energía de activación para el paso 1 es la más alta, por lo tanto, el paso 1 es el paso más lento, es decir, el paso determinante de la velocidad.
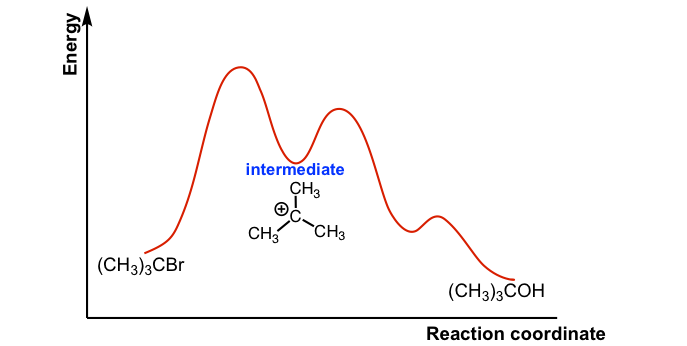
La conexión entre las dos primeras curvas representa el carbocatión intermedio. Generalmente, el intermedio es el producto de una etapa de una reacción y el reactivo para la siguiente etapa. El intermedio está a un nivel de energía relativamente más bajo en comparación con el estado de transición (que está en el pico de una curva), pero el intermedio también es altamente reactivo e inestable.
El efecto de la estructura del sustrato sobre la velocidad de reacción de S N 1
Diferentes sustratos tienen diferentes velocidades de reacción hacia la reacción de SN 1, y la reactividad relativa de los sustratos hacia la reacción de SN 1 se puede resumir como:

Comparando esta tendencia con la de reacción de S N 2, probablemente te des cuenta de que son justo lo contrario. El sustrato terciario es más reactivo hacia S N 1, pero no se somete a S N 2 en absoluto; el sustrato primario y metílico no son reactivos para S N 1, pero son los mejores sustratos para S N 2. Esta comparación es muy importante y útil para nosotros para elegir las condiciones de reacción adecuadas para diferentes sustratos como veremos en la siguiente sección. Por ahora, habrá que entender el razonamiento de la tendencia para S N 1.
Esto se debe a la estabilidad del carbocatión intermedio. El mecanismo muestra que se forma un carbocatión en la etapa de determinación de la velocidad, por lo que cuanto más estable es el carbocatión, más fácilmente se forma, más facilita el paso de determinación de la velocidad y acelera toda la reacción. Por lo tanto, cuanto más estable es el intermedio de carbocatión, más rápida es la velocidad de una reacción de S N 1.
La estabilidad relativa del carbocatión se da a continuación, que los carbocationes terciarios son los más estables y el carbocatión metilo es el menos estable.
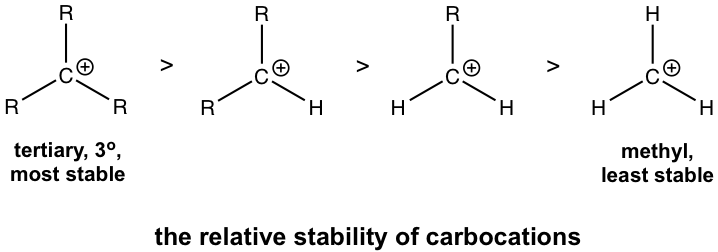
La estabilidad relativa de los carbocationes puede explicarse por el efecto de hiperconjugación. La hiperconjugación es el solapamiento orbital parcial entre el orbital de unión lleno y un orbital adyacente sin llenar (o medio relleno). El carbocatión es la especie deficiente en electrones que tiene el octeto incompleto y el orbital 2p vacío. Si hay un grupo alquilo conectado con carbocatión, entonces hay enlaces sigma C-C o C-H junto al carbono del carbocatión, por lo que los orbitales rellenos de los enlaces sigma podrán solaparse parcialmente con el orbital 2p vacío, compartiendo así la densidad de electrones al carbocatión y obtener el carbocatión estabilizado. Cuanto más grupo R involucrado, más fuerte es el efecto de hiperconjugación. Por lo que el carbocatión terciario (3°) es el más estable. Si bien no hay ningún grupo R en el carbocatión de metilo, CH 3 +, es menos estable.
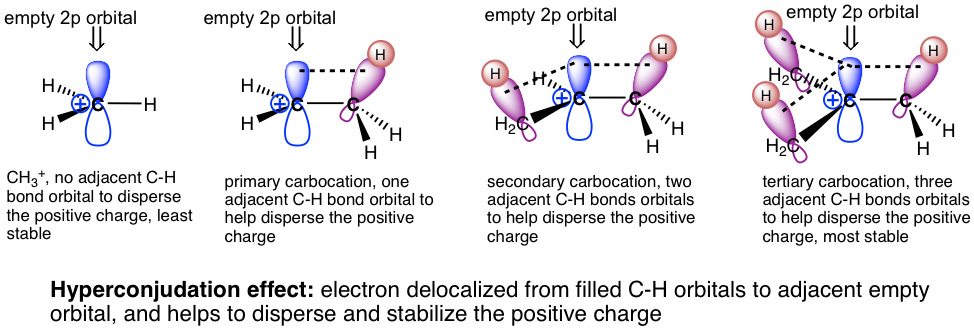
Estereoquímica del mecanismo S N 1
La característica estereoquímica de la reacción de S N 1 es muy diferente a la de S N 2, y por supuesto se puede explicar bien con el mecanismo SN1.

Partiendo del reactivo (S) -3-bromo-3-metilhexano, la reacción de S N 1 produce una mezcla 50:50 de enantiómeros R y S de 3-metil-3-hexanol, que es el producto de mezcla racémica. Esto se debe a que el carbocatión formado en la primera etapa de una reacción de S N 1 tiene la forma plana trigonal, cuando reacciona con nucleófilo, puede reaccionar ya sea desde el lado frontal o desde el lado posterior, y cada lado da un enantiómero. Existe la misma posibilidad de que la reacción ocurra desde cualquier lado, por lo que los dos enantiómeros se forman con la misma cantidad, y el producto es una mezcla racémica.
Se dice que una reacción que convierte un compuesto ópticamente activo en una forma racémica procede con la racemización. Para la reacción de S N 1 que comienza con (un activo óptico) un enantiómero como reactivo, y el centro de quiralidad es también el carbono electrófilo (es decir, la reacción ocurre en el centro de quiralidad), procede con la racemización como se muestra anteriormente.
Ejercicios 7.3
Mostrar el mecanismo detallado para la reacción anterior de (S) -3-bromo-3-metilhexano y agua.
Respuestas a las preguntas de práctica Capítulo 7
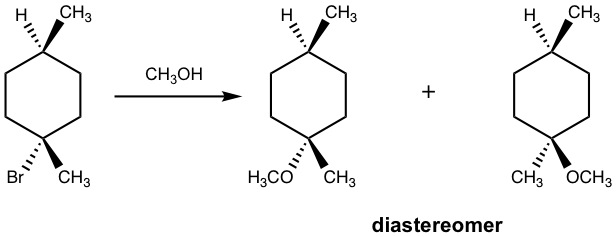
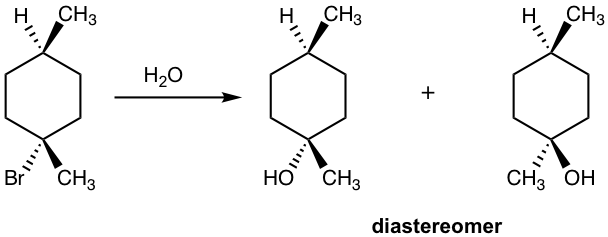
Tenga en cuenta que si el centro de quiralidad del reactivo no es el centro de reacción, o si hay más de un centro de quiralidad en el reactivo, la reacción SN1 no produce la mezcla racémica como ejemplo a continuación.
Ejemplos
Mostrar producto (s) de la siguiente reacción de S N 1:
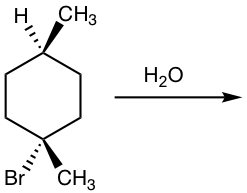
Solución:
L eaving Grupo Efecto sobre S N 1
Igual que para la reacción de S N 2, también se requiere un buen grupo de salida para el mecanismo S N 1, y todas las discusiones que tuvimos antes en la sección 7.3 aplican.
Nucleófilo
A diferencia de una reacción de S N 2, la etapa determinante de velocidad de la reacción de S N 1 no incluye nucleófilos, por lo que teóricamente la fuerza del nucleófilo no tiene efecto sobre la reacción de S N 1. Sin embargo, un nucleófilo fuerte tiene una alta tendencia a ir con la reacción de S N 2 en lugar de S N 1, por lo que un nucleófilo más débil es una mejor opción para S N 1. Para los ejemplos que teníamos hasta el momento, H 2 O es el nucleófilo.
En la práctica, sustancias neutras como H 2 O, ROH, RCOOH se suelen utilizar como nucleófilos en la reacción de S N 1. Cuando estas sustancias se aplican en la reacción, sirven para otra función como solventes. Por lo que se utilizan tanto como nucleófilos como disolventes para la reacción de S N 1, y dicha reacción también se denomina reacción de solvolisis. La reacción de solvolisis es una sustitución nucleofílica en la que el nucleófilo también es una molécula de disolvente. El término solvolisis proviene de: solvente + lisis, eso significa escisión por el solvente. Una reacción de S N 1 suele ser una reacción de solvolisis.
Ejemplos
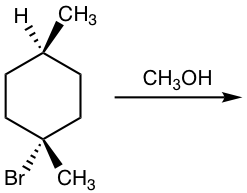 Solución:
Solución: